CP 1&2 Stoffeigenschaften: Löslichkeit und Dichte
Was ist Chemie?
Diese Frage beantwortet der Chemiker oft mit: "Alles ist Chemie". Auch wenn diese Antwort nicht ganz richtig ist, ist sie jedoch auch nicht ganz falsch. Tatsächlich ist der angemessene Rahmen für die Beschäftigung mit Chemie das gesamte materielle Universum, das Lebendige wie das Nichtlebendige. Es kommt nicht darauf an, ob wir eine chemische Reaktion in einer fernen Galaxie beobachten, den Stoffwechsel und Energiehaushalt einer Zelle in einem lebendigen Organismus untersuchen oder in einem Reagenzglas einen neuen Stoff herstellen. Die Gesetze, welche die Zusammensetzung und die Veränderung der Materie (d. h. der Stoffe) bestimmen, sind immer dieselben. Im Laufe der folgenden Monate werden wir einige dieser Gesetze theoretisch, aber wenn immer möglich anhand chemischer Experimente kennenlernen. Das heisst, du wirst Arbeitsmethoden selbst anwenden, Reaktionen durchführen, Beobachtungen notieren und versuchen, diese zu erklären.
In der Chemie geht es also um Stoffe. Die chemische Industrie liefert u. a. folgende Produkte, die in unserem Alltag bzw. in unserem Leben allgegenwärtig sind:
- Brenn- und Treibstoffe (z. B. Benzin oder Heizöl)
- Kunststoffe (z. B. Plastiksäcke)
- Waschmittel, Putzmittel (z. B. Persil, Mr. Proper)
- Lebensmittelzusatzstoffe (z. B. Farbstoffe, Aromastoffe, Konservierungsmittel und andere E-Nummern-Stoffe)
- Medikamente (z. B. Aspirin, Dafalgan)
- Lösungsmittel (z. B. Nitroverdünner)
- Kosmetika (z. B. Deo, Styling Mousse)
- Agrochemikalien wie z. B. Kunstdünger, Pflanzenschutzmittel (u. a. Insektizide, Fungizide)
Bsp.: Brennspiritus (Alkohol)
| Eigenschaften | Reaktion | Aufbau |
|---|---|---|
|
|
Erst später zu verstehen: 
|
Was sind Stoffe?
Mit Stoffen sind alle "fassbaren" Materialien fester, flüssiger oder gasförmiger Natur gemeint. Die Stoffe können sowohl natürlich vorkommen als auch künstlich hergestellt sein.
Luft ist ein Stoff, da eine schnelle Handbewegung in der Luft klar macht, dass da sehr wohl ein Stoff da ist, der einen gewissen Widerstand bietet (= Luftwiderstand). Spätestens wenn man Luft auf rund –200 °C abkühlt, sieht man, dass ein Stoff vorliegt, da die Luft nun flüssig vorliegt. Auf der anderen Seite ist Licht kein Stoff, da sich dieses nicht einfangen und transportieren lässt, also "nicht fassbar" ist.
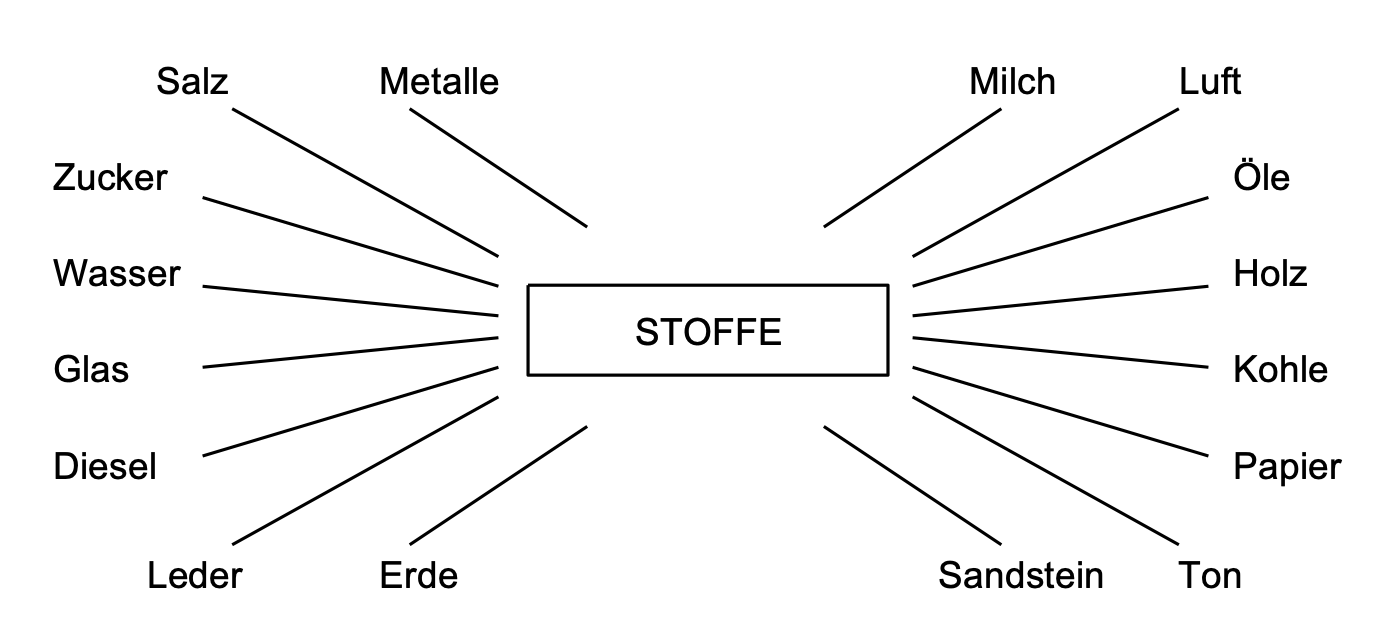
Eigenschaften von Stoffen
- Farbe, Form
- Geruch, Geschmack
- Textur (glatt vs. rauh)
- Aggregatzustand (fest, flüssig, gasförmig)
- Elektrische Leitfähigkeit
- Löslichkeit
- Magnetismus
- Schmelz- und Siedetemperatur (Schmelz- und Siedepunkt)
- Härte, Verformbarkeit
- Dichte
- Brennbarkeit
- Reaktion mit verschiedenen Stoffen (z. B. Säuren)
Beim Stoff Brennspiritus (genau genommen Ethanol, ein Alkohol) haben wir bereits einige Stoffeigenschaften kennengelernt. Dieser flüssige Alkohol wird bei 78 °C gasförmig und bei –114 °C fest. Der Schmelzpunkt dieses Alkohols liegt also bei –114 °C, während die Siedetemperatur bei 78 °C liegt. Diese Werte sind für den Stoff Ethanol konstant und damit charakteristisch. Schmelz- und Siedepunkt eines Stoffs lassen sich experimentell exakt, d. h. quantitativ bestimmen (vgl. späteres CP), wobei man einen Zahlenwert erhält. Andere Stoffeigenschaften wie die Löslichkeit lassen sich quantitativ oder qualitativ bestimmen. Eine Aussage wie "Stoff A löst sich, Stoff B löst sich nicht, Stoff C löst sich sehr gut im Wasser" wäre qualitativer Natur. Eine quantitive Bestimmung der Löslichkeit von Kochsalz in Wasser ist mit relativ einfachen Mitteln möglich. Der ermittelte Zahlenwert gibt an, wie viel Gramm Kochsalz maximal in einer bestimmten Menge Wasser gelöst sein können.
Nimm nun die ausgeteilte CP-Anleitung zur Hand und studiere die Seite 1. Bis dein Gruppenpartner soweit ist, können sich schneller Lesende schon in den ersten Versuch einlesen (S. 2).
Anleitung CP 1&2 (Löslichkeit und Dichte)
Die wichtigsten Laborgeräte (Abbildungen) (Merkblatt, ins Journal einzukleben)
Wie ist das Laborjournal zu führen? (Merkblatt, ins Journal einzukleben)
Muster-Journaleintrag (Versuch 1)
Studiere zuerst die Theorie zur Löslichkeit auf Seite 3 der CP-Anleitung.
Bearbeite dann die Aufgaben 1–5 (die Aufgaben 6–8 sind fakultativ):
Berechne aus den Versuchsdaten die Löslichkeit von Kochsalz in Gramm Salz pro Liter Salzwasser.
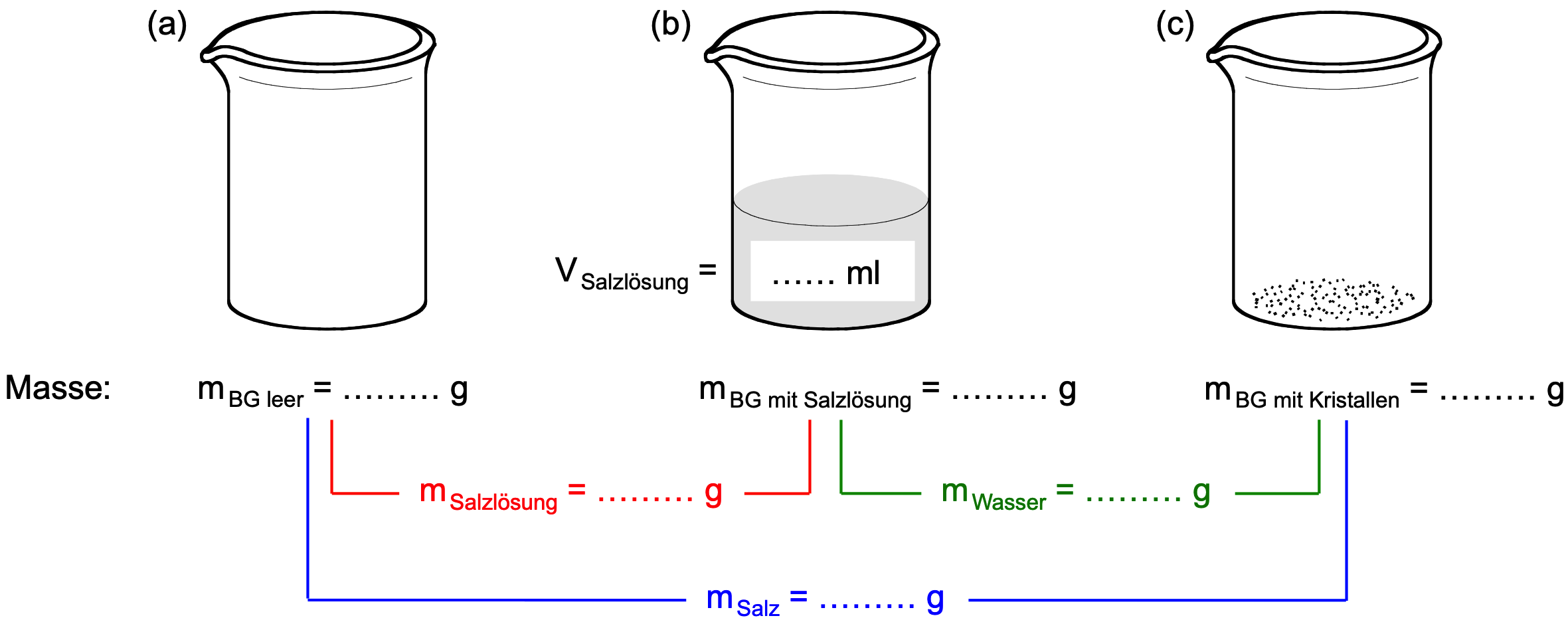
- Erstelle in deinem Journal den Titel Aufgaben und halte die obige Skizze fest. Ergänze die Messergebnisse deiner Gruppe für die Massen der 3 Bechergläser (BG).
- Berechne zuerst, wie schwer das nach dem Eindampfen auskristallisierte Kochsalz war – schliesslich hast du dir im Journal die Masse des leeren Becherglases (mBG leer) und die Masse des Becherglases mit den Kristallen (mBG mit Kristallen) notiert.
- Schlage nach, in welchem Volumen gesättigter Lösung diese Salzkristalle vor dem Eindampfen gelöst waren – du hast ja mit der Pipette eine definierte Menge [ml] an Flüssigkeit entnommen. Halte dieses Volumen ebenfalls in der Skizze fest.
- Damit hast du beide nötige Grössen (Masse Salz und Volumen Salzlösung). Jetzt musst du nur noch auf einen Liter hochrechnen. Vergiss die Einheit nicht.
(Die folgenden Daten stammen von einer Schülergruppe.)
Nach dem Eindampfen der Lösung wog das Becherglas: 49.86 g = mBG mit Kristallen
Das leere Becherglas hatte folgende Masse: 48.25 g = mBG leer
In 5 ml gesättigter Kochsalzlösung (bei 21 °C) waren somit folgende Masse Kochsalz gelöst:
mBG mit Kristallen – mBG leer = 49.86 g – 48.25 g = 1.61 g Kochsalz = mKochsalz gelöst
Daraus lässt sich folgende Löslichkeit [g/l] von Kochsalz in Wasser berechnen (bei 21 °C):
Berechne aus den Versuchsdaten die Löslichkeit von Kochsalz in Gramm Salz gelöst in 100 Gramm Wasser.

- Berechne nun, welche Masse Wasser in der gesättigten Kochsalzlösung vorhanden war (dieses Wasser verdampfte ja später im Trockenschrank). Dazu benötigst du die Masse des mit der Salzlösung gefüllten Becherglases (mBG mit Salzlösung) und die Masse des Becherglases mit den Kristallen (mBG mit Kristallen).
- Damit hast du beide nötige Grössen: Die Masse des Salzes (aus Aufgabe 1a) und die Masse des Wassers (Lösungsmittels). Jetzt musst du nur noch auf 100 g Wasser hochrechnen. Vergiss die Einheit nicht.
Das Becherglas mit 5 ml gesättigter Kochsalzlösung hatte die folgende Masse:
54.26 g = mBG mit Salzlösung
Das Becherglas mit den Kristallen hatte die folgende Masse: 49.86 g = mBG mit Kristallen
In 5 ml gesättigter Kochsalzlösung war somit folgende Masse an Wasser als Lösungsmittel:
mBG mit Salzlösung – mBG mit Kristallen = 54.26 g – 49.86 g = 4.40 g Wasser = mWasser
Daraus lässt sich folgende Löslichkeit [g / 100 g Wasser] von Kochsalz in Wasser berechnen (bei 21 °C):
Berechne die Dichte der gesättigten Kochsalzlösung.

- Die Dichte gibt wieder, wie schwer [g] ein bestimmtes Volumen [ml] eines Stoffs ist, hier ist es die gesättigte Kochsalzlösung.
- Mit der Pipette hast du ein definiertes Volumen gesättigter Kochsalzlösung entnommen – das Volumen ist also bekannt (auch aus Aufgabe 1b).
- Die Masse dieser Flüssigkeit lässt sich leicht berechnen – schliesslich hast du dir im Journal die Masse des mit der Salzlösung gefüllten Becherglases (mBG mit Salzlösung) und die Masse des leeren Becherglases (mBG leer) notiert.
- Damit hast du beide nötige Grössen: Berechne die Dichte. Vergiss die Einheit nicht.
Das leere Becherglas hatte folgende Masse: 48.25 g = mBG leer
Das Becherglas mit 5 ml gesättigter Kochsalzlösung hatte folgende Masse:
54.26 g = mBG mit Salzlösung
5 ml gesättigte Kochsalzlösung (bei 21 °C) hatten somit folgende Masse:
mBG mit Salzlösung – mBG leer = 54.26 g – 48.25 g = 6.01 g = mgesättigte Salzlösung
Die Dichte der gesättigten Kochsalzlösung betrug somit:
mgesättigte Salzlösung / Vgesättigte Salzlösung = 6.01 g / 5 ml = 1.20 g/ml = ρ (bei 21 °C)
Welche Konzentration hatte die Lösung, die du beim Versuch 1 (Bestimmung der Löslichkeit von Kochsalz) hergestellt hast?
Hilfe rund um den Konzentrationsbegriff findest du auf der Seite 3 der CP-Anleitung.
Die (bei 21 °C) gesättigte Kochsalzlösung unter Aufgabe 1a weist eine Konzentration von c = 322 g/l auf.
Die Löslichkeit entspricht also der Sättigungskonzentration (hier bei einer Temperatur von 21 °C), welche wiedergibt, dass in 1 Liter Salzlösung (nicht Wasser!) 322 g Salz gelöst sind (bzw. maximal gelöst sein können).
Der Grenzwert von Nitrat in Trinkwasser beträgt 30 mg/l. Erkläre einem Laien in einem Satz, was man sich unter dieser Angabe "30 mg/l" vorzustellen hat.
Bei der angegeben Zahl muss es sich um eine Konzentration handeln, nicht um eine Dichte.
Es ist präzise zu erklären, auf was bzw. welchen Stoff sich die "30 mg" und "1 Liter" beziehen. Hilfe rund um den Konzentrationsbegriff findest du auf der Seite 3 der CP-Anleitung.
Das bedeutet: In einem Liter Trinkwasser darf maximal 30 mg Nitrat vorhanden (d. h. gelöst) sein.
Achtung: Falsch wäre etwa die folgende Aussage: "Die Konzentration von Nitrat darf nicht höher sein als bei einer Lösung, die beim Lösen von 30 mg Nitrat in einem Liter (reinem) Wasser entsteht."
Eine Konzentration, welche auf eine Liter Flüssigkeit Bezug nimmt, bezieht sich immer auf die Lösung (hier Trinkwasser mit gelösten Stoffen), nicht auf das Lösungsmittel (hier Wasser). Wird nämlich ein Stoff in grosser Menge in einem Liter Wasser gelöst, so beträgt danach das Volumen der Lösung nicht mehr ein Liter, sondern ist grösser.
Natriummetall hat eine Dichte von 0.97 g/cm3.
- Erkläre einem Laien in einem Satz, was man unter dieser Angabe "0.97 g/cm3" versteht.
- Schwimmt das Metall auf Wasser?
Stoffe schwimmen nur auf Wasser, wenn sie spezifisch leichter, d. h. weniger dicht als Wasser selbst sind.
Auswendig zu wissen und einfach zu merken ist die Dichte von Wasser: ρWasser = 1 g/cm3.
Hilfe zur Dichte findest du auf der Seite 4 der CP-Anleitung.
Die angegebene Dichte bedeutet, dass 1 cm3 Natriummetall 0.97 g schwer ist.
Da ρNatrium = 0.97 g/cm3 < ρWasser = 1.00 g/cm3 ist, schwimmt Natrium auf dem Wasser.
112 ml einer Zuckerlösung sind 113.23 g schwer. Berechne die Dichte dieses Zuckerwassers in g/l.
Bei einer Blutspende werden 300 ml Blut entnommen. Wie viele Liter sind das?
1 Milliliter ist ein Tausendstel eines Liters [mille (lat.) = tausend].
1000 ml = 1 Liter
300 ml entsprechen 300/1000 Liter = 0.3 Liter.
Wie viele cm3 Cola befinden sich in einer 5-dl-PET-Flasche?
Auswendig zu wissen: 1 cm3 = 1 ml (vgl. CP-Anleitung, S. 4)
1 Deziliter ist ein Zehntel eines Liters [decem (lat.) = zehn].
1 dl = 0.1 Liter = 100 ml = 100 cm3
5 dl entsprechen 500 cm3.
Was ist der Unterschied zwischen Lösung und Lösungsmittel? Erkläre an einem konkreten Beispiel deiner Wahl.
Hilfe rund um die zwei Begriffe findest du auf der Seite 3 der CP-Anleitung.
Im Versuch 1 wurde Kochsalz in Wasser gelöst. Das entstandene Salzwasser ist eine Lösung. Das Lösungsmittel ist Wasser.
Hinweis: Die eine Definition für die Löslichkeit bezieht sich auf das zugegebene Volumen des Lösungsmittels (hier: Wasser), die andere auf das entstandene Volumen Lösung (hier: Salzwasser).