CP 10 Umkehrbarkeit von chemischen Reaktionen
Sind chemische Reaktionen umkehrbar?
Wie wir bereits erfahren haben, lässt sich das im CP 9 aus Eisen und Sauerstoff entstandene Eisenoxid wieder zu Eisen und Sauerstoff zerlegen:
Um das in einer eindrücklichen exothermen Reaktion entstandene Eisenoxid wieder zu Eisen und Sauerstoff zu zerlegen, ist allerdings sehr viel Energie nötig. Das geschieht zum Beispiel praktisch bei der Gewinnung von Eisen aus Eisenschrott (oberflächlich zu Eisenoxid oxidiert) mithilfe von elektrischem Strom. Eine solche Umkehrreaktion zeigt folglich – energetisch betrachtet – den Verlauf einer endothermen Reaktion (vgl. folgendes Energiediagramm):
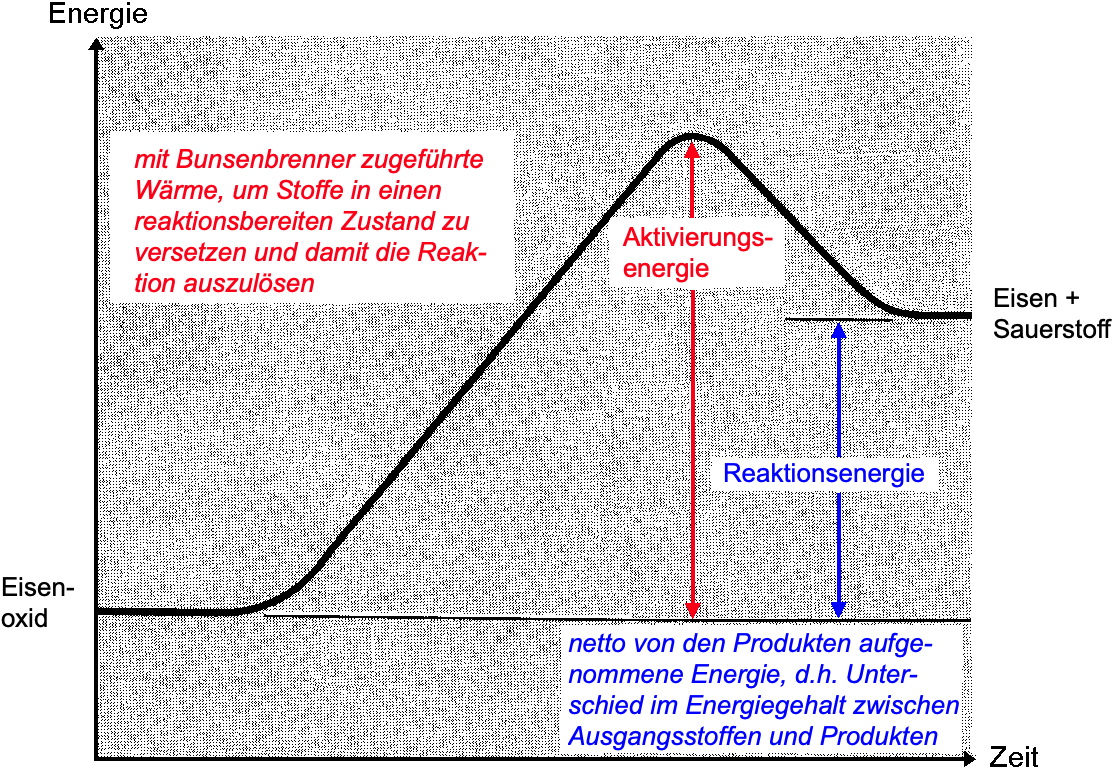
Energiediagramm für die Analyse von Eisenoxid: Es muss stetig (Aktivierungs-)Energie mit dem Bunsenbrenner zugeführt werden, damit alle Stoffanteile reagieren. Ein Teil der Energie ist danach in den neuen Stoffen selbst [thermos (gr.): Wärme; endo (gr.): hinein; wörtlich: Wärme geht (in die Stoffe) hinein]. Ein kleiner Teil der Energie wird als Wärme abgegeben (zu gering, um ein Aufglühen beobachten zu können).
Diese Umkehrbarkeit des Reaktionsverlaufs ist auch bei anderen Reaktionen zu beobachten. D. h., chemische Reaktionen sind grundsätzlich umkehrbar. Allerdings ist es für chemische Reaktionen, bei welchen sehr viele Stoffe beteiligt sind, sehr schwierig bis unmöglich den Verlauf der Reaktion umzukehren. So kann man das komplexe Stoffgemisch Holz zwar problemlos verbrennen (Reaktion mit Sauerstoff), aus den Produkten (im Wesentlichen Kohlenstoffdioxid und Wasser und Asche) lässt sich jedoch kein Holz mehr erzeugen. Das schaffen nur Pflanzenzellen – auf anderem Weg – über mehrere hunderte einzelne Reaktionen. Es gibt jedoch auch chemische Reaktionen, bei welchen nur 3 Stoffe insgesamt beteiligt sind und die Hin- und Rückreaktion mit sehr wenig Energieaufwand möglich ist. Eine solche Reaktion wirst du in diesem CP durchführen.
Nimm nun die CP-Anleitung zur Hand, studiere die Einleitung und starte anschliessend mit dem Versuch.
Anleitung CP 10 (Kupfersulfat-Versuch)
GHS-Symbole (Formular) (Merkblatt, auszufüllen und ins Journal einzukleben)
GHS-Symbole (Hilfsmittel zum Ausfüllen)
Sämtliche Aufgaben müssen bearbeitet werden (Aufgabe 4 wohl als Hausaufgabe).
Zu jeder Chemikalie müssen die Gefahren und Sicherheitsbestimmungen in einem sogenannten Sicherheitsdatenblatt festgehalten sein, so auch zum Stoff 'Kupfer(II)-sulfat-Pentahydrat'.
- Lies im entsprechenden Sicherheitsdatenblatt ausschliesslich die 16 nummerierten Kapitelüberschriften, damit dir klar wird, welche Aspekte in einem Sicherheitsdatenblatt abgedeckt werden müssen. Du musst dir also nichts notieren.
- Lies das Kapitel 2 "Mögliche Gefahren" vollständig durch und notiere dir für den Stoff Kupfersulfat – für 2 H- und 2 P-Sätze – die Codes sowie deren Bedeutung in Worten.
Hinweis: Die Codes (H- und P-Sätze) hast du schon auf der Etikette der Dose mit dem Kupfersulfat gesehen. Deren Bedeutung ist im Sicherheitsdatenblatt zum Stoff 'Kupfer(II)-sulfat-Pentahydrat' nachzulesen.
Die Informationen finden sich im bereits oben verlinkten Sicherheitsdatenblatt auf der Seite 1.
(Gehe nun zurück zum Versuch.)
Ergänze die Lücken im separat abgegebenen Blatt 'GHS-Piktogramme'. Beachte die folgenden Vorgaben.
- Lies auf deinem Ausdruck die Angaben zum ersten GHS-Piktogramm.
- Ergänze in deinem Ausdruck – mithilfe dieses Dokuments – die Bedeutung des Gefahrenpiktogramms (zweite Spalte) und halte je 1 Beispiel eines Stoffs (dritte Spalte) fest.
- Gehe analog für die nächsten acht GHS-Symbole vor.
- Klebe das Blatt ganz hinten in dein Heft ein.
Die Informationen finden sich im bereits oben verlinkten Dokument.
(Gehe nun zurück zum Versuch.)
Berechne die Wassermenge, die 1 Gramm blaues Kupfersulfat enthält:
- in Gramm;
- in Massen-%.
- Die Flüssigkeit, die sich am Uhrglas bildet, ist auf das Entweichen von Wasserdampf zurückzuführen, der am kalten Uhrglas kondensiert. Da somit ein Stoff als Gas entwichen ist, wird das im Tiegel zurückbleibende weisse Pulver leichter.
- m Wasser = (m Tiegel_leer + m blaues Pulver alleine) – m Tiegel mit weissem Pulver
- Nun musst du die Masse des eingewogenen blauen Pulvers (m blaues Pulver alleine) auf 1 Gramm hochrechnen. Die Wassermasse (m Wasser) erhöht sich um den gleichen Faktor.
- Am Schluss musst du noch auf Prozent umrechnen [pro centum (lat.): pro Hundert]: 1 % ist also 1 Teil von hundert Teilen. Bsp.: Der menschliche Körper besteht aus ca. 70 % Wasser, d. h., bei einer 100-kg-Person sind 70 kg auf den Stoff Wasser zurückzuführen. Bei unserem Versuch entspricht also 1 g blaues Pulver 100 %.
(Die folgenden Daten stammen von einer Schülergruppe.)
Aus 0.50 g blauem Kupfersulfat entsteht 0.32 g weisses Kupfersulfat. Damit beträgt der Massenverlust 0.18 g, was der Masse an entwichenem Wasserdampf entspricht.
1 g blaues Kupfersulfat enthält also 2 · 0.18 g = 0.36 g Wasser.
Prozentualer Anteil von Wasser in blauem Kupfersulfat: (0.36 g / 1 g) · 100 % = 36 % Wasser.
Ein Wassergehalt von über 36 % weisst auf ungenaues Arbeiten hin (Fehlbedienung der Waage, Pulver verschüttet oder zu stark erhitzt, sodass sich das Kupfersulfat chemisch zersetzt hat). Kupfersulfat kann nicht mehr Wasser enthalten, es enthält 36 % durch Anziehungskräfte im Kristallgitter gebundenes Wasser.
- Welcher Vorgang in diesem Versuch entspricht einer exothermen, welcher einer endothermen chemischen Reaktion?
- Erstelle ein Energiediagramm für die Bildung des weissen Pulvers.
- Erstelle ein Energiediagramm für den Vorgang, der durch Zugabe von Wasser zum weissen Pulver ausgelöst wurde. Beachte die folgenden Vorgaben.
- Die endotherme Reaktion ist immer jene Reaktion, die eine permanente Energiezufuhr benötigt. Die exotherme Reaktion ist jene, die netto Wärme an die Umgebung abgibt.
- Das Energiediagramm für die Bildung des weissen Pulvers entspricht vom Verlauf her jenem im Theorieteil.
- Erstelle das 2. Diagramm auf gleicher Höhe wie das erste, damit ersichtlich wird, dass es sich um die Umkehrreaktion handelt. Das 2. Diagramm ergibt sich so quasi durch Spiegelung des 1. Diagramms. Zeichne in beiden Diagrammen die Aktivierungsenergie (EA) und die Reaktionsenergie (ER) ein
Endotherme Reaktion (Erhitzem von blauem Kupfersulfat)
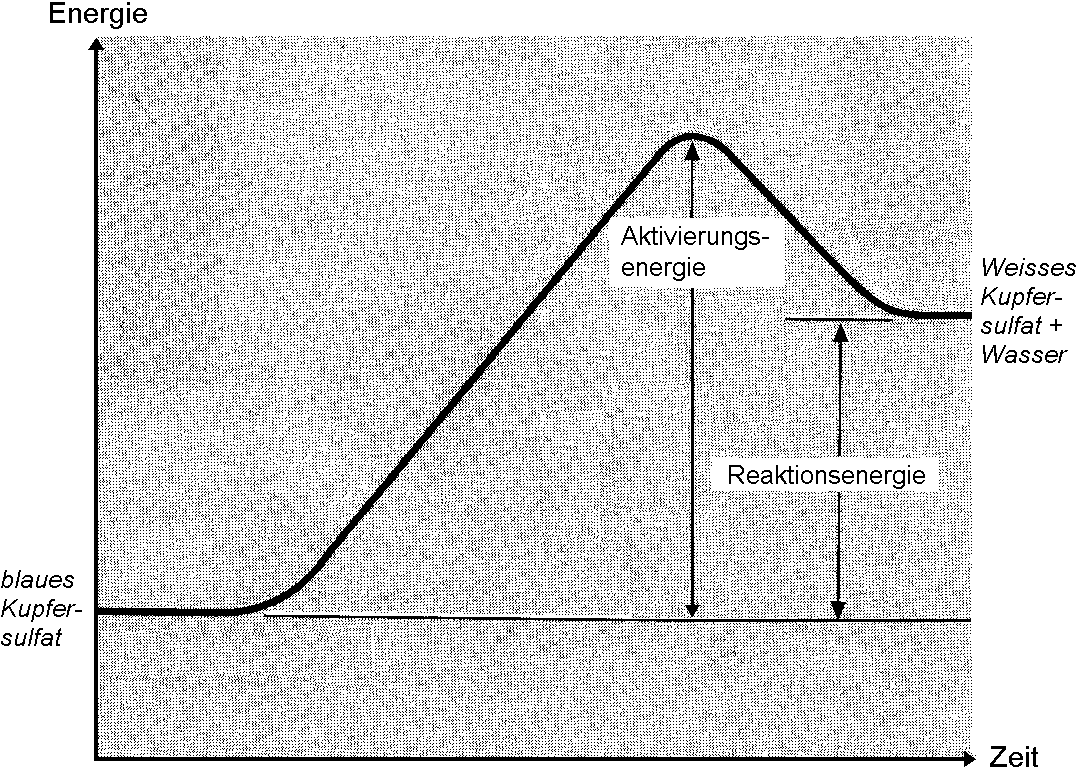
Für die Bildung von weissem Kupfersulfat aus blauem Kupfersulfat muss dauernd Energie zugeführt werden (= endotherme Reaktion). Auch kann keine Energieabgabe wie Aufglühen oder Ähnliches beobachtet werden.
Exotherme Reaktion (Wasserzugabe zu weissem Kupfersulfat)
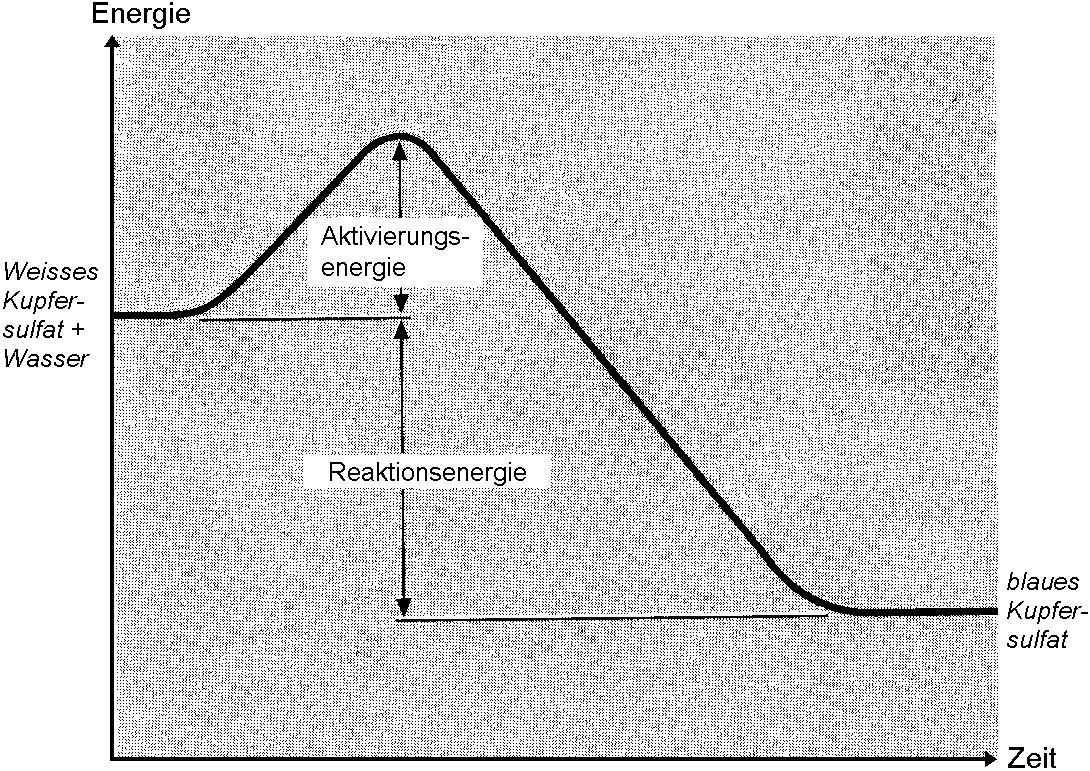
Die Rückreaktion von weissem Kupfersulfat (22 °C) zu blauem Kupfersulfat (30 °C) – nach der Zugabe von 3 Tropfen Wasser – ist mit einer messbaren Wärmeabgabe verbunden (= exotherme Reaktion).