CP 11 Chemische Formeln und Reaktionsgleichungen
Die chemische Formelsprache ist international
Gewisse chemische Formeln kennst du vermutlich bereits: H2O für Wasser, CO2 für Kohlenstoffdioxid oder C6H12O6 für Traubenzucker (Glucose). Chemische Formeln werden verwendet, um beispielsweise zu beschreiben, wie der Aufbau von Stoffen aussieht oder wie Stoffe miteinander reagieren können. Zum Beispiel kann der komplizierte Prozess der Fotosynthese bei Pflanzen mit der folgenden Reaktionsgleichung wiedergegeben werden:
6 CO2 (g) + 6 O2 (g) → C6H12O6 (s) + 6 H2O (l)
Die obige Reaktionsgleichung bzw. die darin aufgeführten chemischen Formeln werden überall auf dieser Welt identisch verwendet. Somit spielt es keine Rolle mehr, in welcher Sprache (z. B. Finnisch) oder mit welchem Schriftzeichen (z. B. chinesischen) über eine Reaktion berichtet wird. Die chemische Formelsprache ist international. In diesem Praktikum lernst du, was eine chemische Formel aussagt und wie man Reaktionsgleichungen aufstellt.
Die chemische Formel
Die chemische Formel gibt als Kurzschreibweise Auskunft über den atomaren Aufbau eines Reinstoffs, wobei bei Verbindungen (Reinstoffe aus verschiedenen Atomen) entweder die sogenannte Molekülformel oder die Verhältnisformel zum Einsatz kommt:
Molekülformel bei Molekülen
- 2 H-Atome, 1 S-Atom und 4 O-Atome bauen ein Schwefelsäuremolekül (H2SO4) auf.
- Eine '1' schreibt man nicht, also nicht etwa H2S1O4.
- Schwefelsäure ist also ein Stoff, der aus unzähligen H2SO4-Teilchen besteht.
- Molekülformel bei Nichtmetall + Nichtmetall (bei Molekülen)
Verhältnisformel bei Verbänden
- Atomzahlverhältnis: Ag : O = 18 : 9 = 2 : 1 (gekürzt)
- Silberoxid (Ag2O) ist also ein Stoff, der aus unzähligen Ag- und O-Atomen im Verhältnis 2 : 1 in einem Gitter besteht.
- Achtung: Es gibt keine Ag2O-Teilchen.
- Verhältnisformel bei Metall + Nichtmetall (bei Verbänden)
Aufgabe 1:
Übertrage die obige Abbildung inkl. Erläuterungen ins Journal.
Chemische Formeln bei Elementarstoffen
Bei metallischen Elementarstoffen (Reinstoffe aus gleichen Atomen) bilden sich Verbände, wobei man einfach das Elementsymbol als chemische Formel schreibt (vgl. das Beispiel Silber ganz rechts in der folgenden Abbildung). Die meisten nichtmetallischen Elementarstoffe wie etwa Stickstoff (ganz links in der Abb.) bilden zweiatomige Moleküle, ausser die Edelgase (in der Mitte der Abb.), deren Atome sich gar nicht binden:
Tiefgesetzte Zahl vs. Vorzahl bei molekular aufgebauten Stoffen
| Formel und Vorzahl | Kugelmodell | Bezeichnung |
|---|---|---|
| H | 1 Wasserstoffatom (1 H-Atom) | |
| 2 H | 2 nicht verbundene Wasserstoffatome (2 H-Atome) | |
| H2 | 1 Wasserstoffmolekül (1 H2-Molekül) | |
| 2 H2 | 2 Wasserstoffmoleküle (2 H2-Moleküle) |
Löse nun die Aufgaben 2–3.
Die Reaktionsgleichung
Eine Reaktionsgleichung beschreibt einen chemischen Vorgang, bei welchem die Ausgangsstoffe (= Edukte) einer chemischen Reaktion zu den Endstoffen (= Produkte) reagieren. Um eine Reaktionsgleichung aufzustellen, werden die chemischen Formeln der beteiligten Stoffe benötigt sowie Symbole (+ und →) verwendet.
Wie wir bereits wissen, werden bei einer chemische Reaktion Atome weder verändert noch verbraucht, sondern bloss umgruppiert. Damit ändert sich die Anzahl der Atome bei einer chemischen Reaktion nicht. In der Folge muss auch bei einer Reaktionsgleichung darauf geachtet werden, dass auf der Seite der Edukte insgesamt gleich viele Atome derselben Sorte vorhanden sind wie auf der Seite der Produkte. Ist dies nicht der Fall, müssen sogenannte stöchiometrische Koeffizienten eingesetzt werden. Wie in der Mathematik die "2" z. B bei "2x" einen Koeffizienten darstellt und die Anzahl der x angibt, bezieht sich der stöchiometrische Koeffizient "2" bei der Angabe "2 H2O" auf die Anzahl der Wassermoleküle. Im Folgenden schauen wir uns das Aufstellen einer Reaktionsgleichung bzw. das Bestimmen der stöchiometrischen Koeffizienten an zwei Beispielen an:
Bsp. 1: Synthese von Wasser
| 1. | Wortgleichung aufstellen: + : "und" → : "reagiert zu" |
|
| 2. | Chemische Formeln angeben: | |
| 3. | Gedankliche Vorstellung im Kugelmodell (optional): | |
| 4. | Atome zählen: | Rechts fehlt ein O-Atom. |
| 5. | Unerlaubte Korrektur: | Die Situation mit dem fehlenden O-Atom rechts könnte – rein formal – wie folgt korrigiert werden: Damit wäre rein mathematisch die Gleichung erfüllt, d. h. links und rechts gleich viele Atome. Es darf jedoch kein einzelnes O-Atom übrig bleiben, da als Produkt nur H2O anfallen darf. Auch eine Korrektur der Formel von Wasser zu H2O2 ist verboten, das dies ein anderer Stoff (Wasserstoffperoxid) mit völlig anderen Eigenschaften darstellt. Formeln (vgl. Schritt 2) dürfen nie verändert werden. |
| 6. | Stöchiometrische Koeffizienten bestimmen (Schritt 1): | Damit das O-Atom auf der rechten Seite der Gleichung nicht mehr allein ist, denkt man sich ein zweites H2O-Molekül: O-Bilanz: links: O2 = 2 O rechts: 2 H2O = 2 O H-Bilanz: links: H2 = 2 H rechts: 2 H2O = 4 H |
| 7. | Stöchiometrische Koeffizienten bestimmen (Schritt 2): | Damit auch die Anzahl der H-Atome stimmt, denkt man sich ein zweites H2-Molekül: |
| 8. | Kontrolle: | H-Bilanz: links: 2 H2 = 4 H rechts: 2 H2O = 4 H O-Bilanz: links: O2 = 2 O rechts: 2 H2O = 2 O |
| 9. | Hinweise: | Ist der stöchiometrische Koeffizient 1, so wird dieser üblicherweise nicht geschrieben. Man schreibt also O2, nicht 1 O2. Eine Verhältnisformel wie Ag2O (Verband) wird beim Bestimmen der stöchimetrischen Koeffizienten wie eine Molekülformel behandelt. Im Bsp. würde man also 2 Ag-Atome und 1 O-Atom zählen. Die stöchiometrischen Koeffizienten sind sinnvollerweise ganzzahlig und so klein wie möglich. Bei den folgenden Gleichungen sind folglich alle stöchiometrischen Koeffizienten mit 2 zu erweitern (Bsp. 1) bzw. mit 2 zu kürzen (Bsp. 2): Bsp. 1: H2 + 0.5 O2 → H2O | · 2 Bsp. 2: 4 H2 + 2 O2 → 4 H2O | : 2 |
Bsp. 2: Verbrennung von Campinggas
Aufgabe 4:
Schau das folgende Video (5:52 min) und übertrage das Schlussbild ins Journal.
Löse nun die restlichen Aufgaben ab Aufgabe 5.
Es liegen keine Dateien vor.
Die Aufgaben 1–9 müssen bearbeitet werden. Die Aufgabe 10 ist für schnellere Leute.
(Diese Aufgabe solltest du bereits bearbeitet haben.)
Übertrage die Abbildung zur Bedeutung der chemischen Formel im Falle der Molekül- bzw. Verhältnisformel aus dem Theorieteil in dein Journal.
Die chemische Formel
Molekülformel bei Molekülen
- 2 H-Atome, 1 S-Atom und 4 O-Atome bauen ein Schwefelsäuremolekül (H2SO4) auf.
- Eine '1' schreibt man nicht, also nicht etwa H2S1O4.
- Schwefelsäure ist also ein Stoff, der aus unzähligen H2SO4-Teilchen besteht.
- Molekülformel bei Nichtmetall + Nichtmetall (bei Molekülen)
Verhältnisformel bei Verbänden
- Atomzahlverhältnis: Ag : O = 18 : 9 = 2 : 1 (gekürzt)
- Silberoxid (Ag2O) ist also ein Stoff, der aus unzähligen Ag- und O-Atomen im Verhältnis 2 : 1 in einem Gitter besteht.
- Achtung: Es gibt keine Ag2O-Teilchen.
- Verhältnisformel bei Metall + Nichtmetall (bei Verbänden)
(Fahre nun im Theorieteil weiter mit dem Kapitel "Chemische Formeln bei Elementarstoffen".)
Geh in deinem Journal zurück zum CP 9 und dort zur Aufgabe 3. Ergänze dort für jeden Stoff – direkt hinter dem Namen – die chemische Formel.
(Bearbeite nun die Aufgabe 3.)
Beschreibe möglichst präzise – und unter Verwendung von Fachbegriffen und einer Zeichnung – den Aufbau der zwei Stoffe Kohlenstoffdioxid (CO2) und Natriumchlorid (NaCl).
- Überlege dir zuerst, welcher Stoff molekular bzw. als Verband vorliegt.
- Nichtmetall + Nichtmetall → Moleküle; Metall + Nichtmetall → Verband
- Du kannst dich an den Beispielen im Theorieteil orientieren (vgl. deine Notizen zur Aufg. 1).
Kohlenstoffdioxid besteht aus 3-atomigen Molekülen, wobei ein CO2-Molekül aus 1 C- und 2 O-Atomen besteht.
Molekülformel bei Nichtmetall-Nichtmetall-Kombination (hier C und O)
Natriumchlorid besteht aus unzähligen Na- und Cl-Atomen im Verhältnis 1:1 in einem Gitter (= Verband).
Verhältnisformel bei Metall-Nichtmetall-Kombination (hier Na und Cl)
(Fahre nun im Theorieteil weiter mit dem Kapitel "Die Reaktionsgleichung".)
(Diese Aufgabe solltest du bereits bearbeitet haben. Hier findet sich eine Darstellung des Schlussbildes in hoher Auflösung.)
Schau das folgende Video (5:52 min) und übertrage das Schlussbild ins Journal.
Das Schlussbild aus dem Video zum Aufstellen der Reaktionsgleichung für die Verbrennung von Campinggas liegt auch im PDF-Format vor.
Bestimme die stöchiometrischen Koeffizienten der Reaktionsgleichung, welche die Synthese von Ammoniak (NH3) beschreibt:
__ N2 + __ H2 → __ NH3
- Wähle bei der Webseite "Reaktionsgleichungen ausgleichen" (PhET, University of Colorado, Boulder) den Bereich "Einleitung" (vgl. Abbildung unten) und gehe die folgenden Schritte 2–4 durch:
- Das erste Beispiel ist die Synthese von Ammoniak. Setze die Anzahl aller Moleküle auf 1.
- Wähle unter "Werkzeuge" die Säulen aus: Damit wird die Anzahl der Atome jeder Atomsorte angezeigt.
- Bestimme die stöchiometrischen Koeffizienten, d. h. verändere gemäss dem in deinem Journal festgehaltenden Vorgehen (Verbrennung von Campinggas) die Anzahl der Moleküle so, dass links und rechts gleich viele Atome von jeder Atomsorte vorliegen:
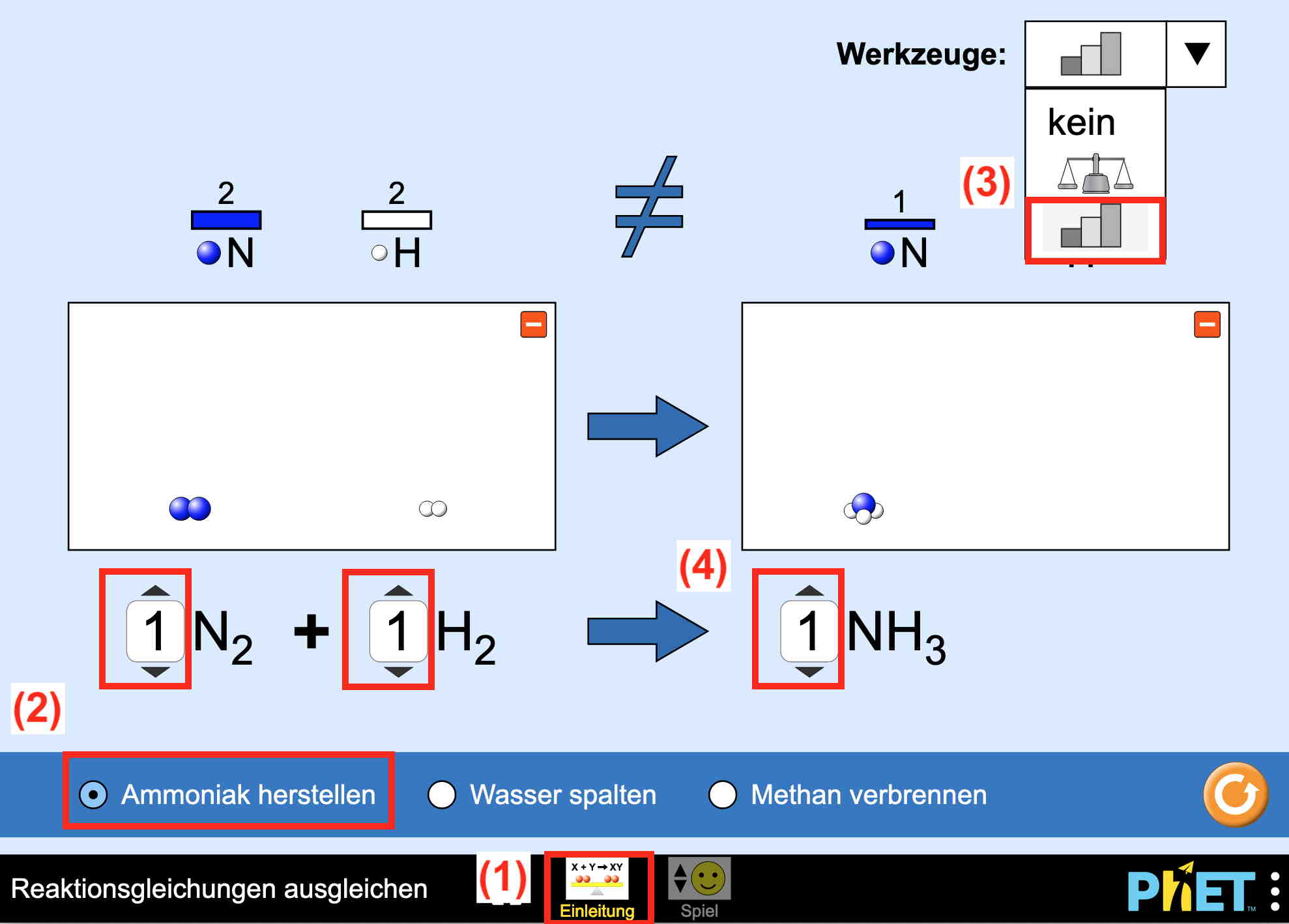
Benutzeroberfläche zum Bestimmen der stöchiometrischen Koeffizienten am Beispiel der Synthese von Ammoniak: interaktive Simulation (PhET, University of Colorado, Boulder)
- Lass diese Webseite am besten gleich geöffnet (wir schauen noch andere Beispiele an).
(Damit du diese Einstellungen effizient vornehmen kannst, kannst du mit den Tastaturbefehlen "Ctrl+Tab" und "Ctrl+Umschalt+Tab" zwischen den Browser-Tabs (CP-Webseite und externe Webseite) wechseln. Noch einfacher geht's mit "Ctrl+PageUp" "Ctrl+PageDown", falls das dein Gerät unterstützt.)
N2 + 3 H2 → 2 NH3
Lösungsweg
Der Lösungsweg muss nur festgehalten werden, wenn du nicht selbst (d. h. ohne Hilfsmittel) auf die Lösung gekommen bist.
Bestimme die stöchiometrischen Koeffizienten der Reaktionsgleichung, welche die Verbrennung von Erdgas bzw. Methan (CH4) beschreibt:
__ CH4 + __ O2 → __ CO2 + __ H2O
- Wähle bei der Webseite "Reaktionsgleichungen ausgleichen" (PhET, University of Colorado, Boulder) den Bereich "Einleitung" (vgl. Abbildung unten) und gehe die folgenden Schritte 2–4 durch:
- Wechsle im unteren Bereich auf das Beispiel "Methan verbrennen". Setze die Anzahl aller Moleküle auf 1.
- Wähle unter "Werkzeuge" die Säulen aus: Damit wird die Anzahl der Atome jeder Atomsorte angezeigt.
- Bestimme die stöchiometrischen Koeffizienten, d. h. verändere gemäss dem in deinem Journal festgehaltenden Vorgehen (Verbrennung von Campinggas) die Anzahl der Moleküle so, dass links und rechts gleich viele Atome von jeder Atomsorte vorliegen:
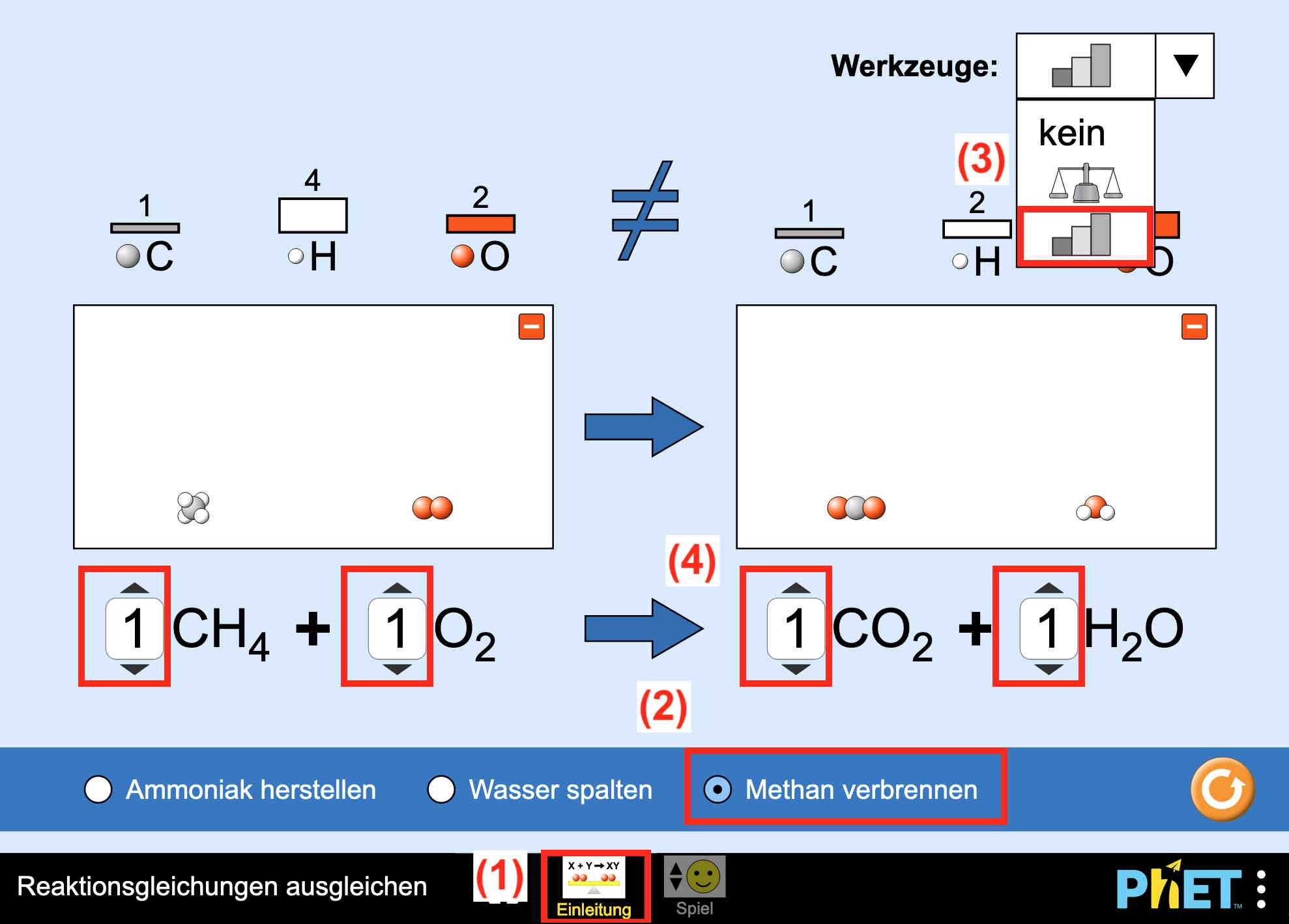
Benutzeroberfläche zum Bestimmen der stöchiometrischen Koeffizienten am Beispiel der Verbrennung von Methan: interaktive Simulation (PhET, University of Colorado, Boulder)
- Lass diese Webseite am besten gleich geöffnet (du kommst evtl. noch zum Bereich "Spiel").
(Damit du diese Einstellungen effizient vornehmen kannst, kannst du mit den Tastaturbefehlen "Ctrl+Tab" und "Ctrl+Umschalt+Tab" zwischen den Browser-Tabs (CP-Webseite und externe Webseite) wechseln. Noch einfacher geht's mit "Ctrl+PageUp" "Ctrl+PageDown", falls das dein Gerät unterstützt.)
CH4 + 2 O2 → CO2 + 2 H2O
Lösungsweg
Der Lösungsweg muss nur festgehalten werden, wenn du nicht selbst (d. h. ohne Hilfsmittel) auf die Lösung gekommen bist.
Bestimme die stöchiometrischen Koeffizienten der Reaktionsgleichung für die Bildung von Stickstoffdioxid (NO2), welches als Ausgangsstoff zur Synthese von Salpetersäure dient:
__ NH3 + __ O2 → __ NO2 + __ H2O
Kennzeichne die Produkte und Edukte in dieser Reaktionsgleichung.
- Orientiere dich an dem in deinem Journal festgehaltenden Vorgehen (Verbrennung von Campinggas).
- Die Anzahl H-Atome ist zu Beginn links 3 und rechts 2. Du kannst also auf der rechten Seite berechnen, welche Zahl mal 2 die Zahl 3 ergibt.
- Alternativ kannst du auch mit den kleinsten gemeinsamen Vielfachen (kgV) von 3 und 2, also 6 rechnen und dir Folgendes überlegen:
- Linke Seite: Welche Zahl mal 3 ergibt die Zahl 6?
- Rechte Seite: Welche Zahl mal 2 ergibt auch die Zahl 6?
4 NH3 + 7 O2 → 4 NO2 + 6 H2O
Edukte Produkte
Lösungsweg
Der Lösungsweg muss nur festgehalten werden, wenn du nicht selbst (d. h. ohne Hilfsmittel) auf die Lösung gekommen bist.
Formuliere die Reaktionsgleichung für die Reaktion von Eisen und Sauerstoff zu Eisenoxid (FeO).
- Überlege dir zuerst für jedes Edukt, ob ein Metall oder ein Nichtmetall vorliegt.
- Nichtmetallische Elementarstoffe liegen häufig als 2-atomige Moleküle vor (die Formel von Sauerstoff solltest du auswendig wissen). Metallische Elementarstoffe bilden Verbände, für welche man schlicht das Elementsymbol schreibt.
- Falls du die Theorie zu den chemischen Formeln von Elementarstoffen nochmals studieren willst, findest du das entsprechende Kapitel hier.
2 Fe + O2 → 2 FeO
Diese Reaktionsgleichung beschreibt die stoffliche Umwandlung beim Versuch "Synthese von Eisenoxid" (CP 9). Gehe deshalb in deinem Journal zurück zum CP 9 und dort zur Aufgabe 4. Vergleiche die dortige Abbildung (vgl. unten) mit der obigen Reaktionsgleichung und ergänze dort die Gleichung:
Formuliere die Reaktionsgleichung für die Reaktion von Kupferoxid (CuO) mit Kohlenstoff (C) zu Kupfer und Kohlenstoffdioxid.
- Metallische Elementarstoffe bilden Verbände, für welche man schlicht das Elementsymbol schreibt. Kohlenstoff ist das einzige Nichtmetall, welches ein Atomgitter bildet (Verband).
- Die Formel von Kohlenstoffdioxid solltest du auswendig wissen und ist CO2.
2 CuO + C → 2 Cu + CO2
Diese Reaktionsgleichung beschreibt die stoffliche Umwandlung beim Versuch "Kupfermetallgewinnung aus Kupferoxid". Gehe deshalb in deinem Journal zurück zum CP 9 und dort zur Aufgabe 7. Vergleiche die dortige Abbildung (vgl. unten) mit der obigen Reaktionsgleichung und ergänze dort die Gleichung:
Für schnellere Leute bzw. um mehr Routine beim Bestimmen von stöchiometrischen Koeffizienten zu erlangen, stehen noch weitere Übungen auf einer externen Website zur Verfügung. Öffne die nächste Karte "Vorgaben".
- Wähle bei der folgenden Webseite den Bereich "Spiel" (vgl. Abbildung unten).
- Das Niveau 1 ist sehr einfach und kann weggelassen werden. Du kannst also mit dem Niveau 2 starten.
- Das Niveau 3 entspricht den anspruchsvolleren Aufgaben, wie sie dir auch an Prüfungen begegnen können.
- Öffne nun die Simulation "Reaktionsgleichungen ausgleichen" (PhET, University of Colorado, Boulder) und gehe die obigen Schritte 1–3 durch.
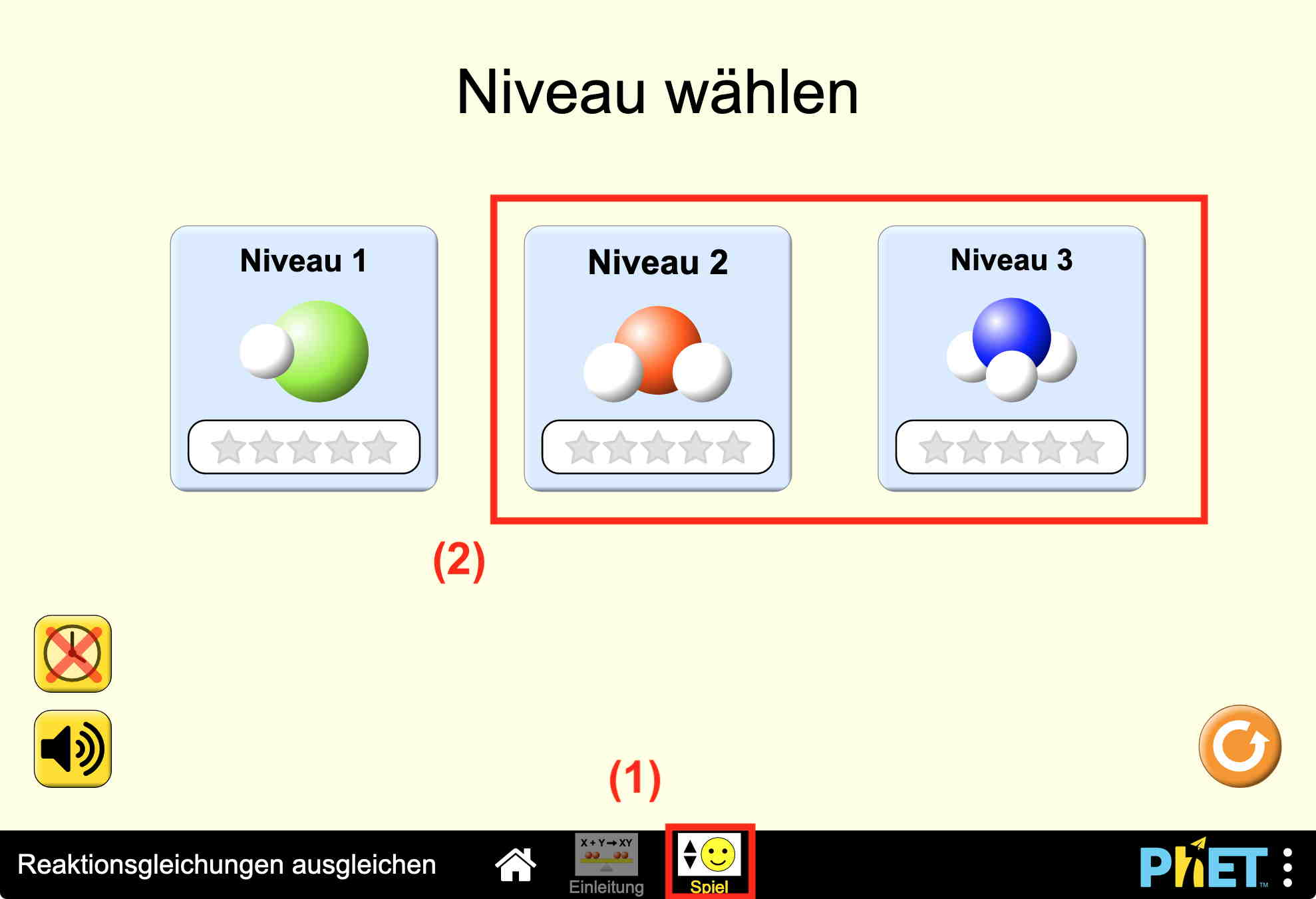
Benutzeroberfläche zum Bestimmen der stöchiometrischen Koeffizienten (Niveau 1–3) für verschiedene Reaktionsgleichungen im Bereich "Spiel": interaktive Simulation (PhET, University of Colorado, Boulder)
Erklärungen und Lösungen zu den Aufgaben können direkt auf der Webseite angezeigt werden.