CP 12&13 Stöchiometrische Berechnungen
Wozu dient die Stöchiometrie?
Wie viel Benzin muss in einen Zylinder eingespritzt werden, damit der Motor optimal läuft? Wie viele Tonnen CO2 werden bei der Verbrennung von einer Tonne Erdgas produziert? Wie viel von den jeweiligen Edukten muss man in ein Reaktionsgefäss geben, damit nur der gewünschte Stoff entsteht und keine Edukte übrigbleiben?
Um solche Fragen beantworten zu können, benötigen wir die Stöchiometrie, welche oft etwas salopp auch als "chemisches Rechnen" bezeichnet wird. Im vorangegangenen Kapitel "Chemische Formeln und Reaktionsgleichungen" hast du bereits gelernt, wie Reaktionsgleichungen aufgestellt werden. Dieses Wissen wirst du in diesem Kapitel wieder benötigen.
Bsp.: Verbrennung von Erdgas
Erdgas wird in der Schweiz v. a. dazu verwendet, um in der Industrie Prozesswärme bereitzustellen. Bei der Verbrennung entsteht CO2, dessen Freisetzung mit einer CO2-Abgabe von 120 Franken pro Tonne dem entsprechenden Unternehmen belastet wird. Die Reaktionsgleichung für die Verbrennung von Erdgas bzw. Methan (CH4) kennen wir bereits:
Wie gross ist die CO2-Abgabe pro Tonne verbranntem Erdgas? Die stöchiometrischen Koeffizienten besagen, dass aus 1 CH4-Molekül genau 1 CO2-Molekül entsteht. Wir können zwar die Molekülmasse der zwei Stoffe berechnen, doch welcher Zusammenhang besteht zwischen der Molekülmasse in Unit und der Masse, die man effektiv messen kann, zum Beispiel 1 Tonne Methan?
Das Mol verknüpft die Einheit Unit mit der Einheit Gramm
Problem:
Keine Waage misst in Units (u). Die Masse von Atomen, aber auch daraus zusammengesetzten Molekülen in der sonst üblichen Einheit Gramm ist unwägbar klein. Das gilt auch für die Masse von einem CH4-Molekül. Wie lässt sich nun die Teilchenmasse (in u), welche eine Grösse auf der Teilchenebene (Modellebene) darstellt, mit der Stoffebene (alles was man sehen/messen kann; mit Einheiten wie g, ml) verknüpfen? D. h., wie kann man zum Beispiel berechnen, wie viele CH4-Moleküle in 1 Tonne Methan (CH4) vorkommen?
Die Einheit "Unit" für die relative Atommasse ist bloss eine Vergleichsgrösse. So ist 1 Mg-Atom gerundet 24 u schwer und damit doppelt so schwer wie 1 C-Atom (mit 12 u Masse) und 24-mal schwerer als 1 H-Atom (mit 1 u Masse).
Lösung:
Für das Beispiel Erdgasverbrennung wäre es praktisch, sich nicht auf ein CH4-Teilchen (mit der relativen Molekülmasse von 16 u) zu beziehen, sondern auf eine Teilchenmenge, die im konkreten Fall gerade 16 g schwer ist. Das hätte den Vorteil, dass man die Zahlen für die relativen Atommassen aus dem Periodensystem verwenden könnte, wobei diese Zahlen mit der Einheit Gramm (g) anstelle der Einheit Unit (u) versehen werden:
Diese gesuchte Teilchenmenge entspricht 6.02 · 1023 Teilchen. Diese Zahl stellt den Zusammenhang zwischen den Einheiten Unit (→ PSE, Teilchenebene) und Gramm (Stoffebene) her.
16 g Methan (CH4) entsprechen also 6.02 · 1023 Molekülen; und 12 g Kohlenstoff (C) entsprechen 6.02 · 1023 Atomen. Diese enorme Teilchenmenge können wir uns nicht vorstellen. Deshalb ist es sinnvoll, für die Anzahl von 6.02 · 1023 Teilchen einen neuen Begriff respektive eine neue Grösse einzuführen. Diese neue Grösse ist das Mol. Sie ist für Berechnungen in der Chemie eine enorm wichtige Grösse:
Das Mol ist eine Grösse für die Stoffmenge. Die Einheit ist [mol]. Die Teilchenmenge von 6.02 · 1023 Teilchen (rund 600 Trilliarden Teilchen) heisst Avogadro-Zahl und entspricht 1 mol.
6.02 · 1023 Teilchen (Atome, Moleküle) pro Mol = Avogadro-Konstante NA.
Bsp. 1:
Die Grösse "Mol" kann man mit der Grösse "Dutzend" vergleichen. Ein dutzend Leute sind 12 Leute. 6 Leute entsprechen einem halben Dutzend Leuten.
Analog sind: 1 mol Teilchen = 6.02 · 1023 Teilchen; 0.5 mol = 3.01 · 1023 Teilchen; 0.1 mol = 6.02 · 1022 Teilchen.
Die Zahl 24.31 bei Magnesium lässt sich auch wie folgt lesen: 24.31 g ist die Masse von 1 mol Mg-Atomen.
Bsp. 2:
Sauerstoff (O): 16 g Sauerstoff (aus PSE) enthalten 6.02 · 1023 Sauerstoffatome.
16 g Sauerstoff entsprechen also 1 mol Sauerstoffatomen (O), aber nur 0.5 mol Sauerstoffmolekülen (O2), da es 2 O-Atome braucht, um ein O2-Molekül zu bilden.
Sauerstoff besteht aus 2-atomigen Molekülen. Damit liegen jeweils doppelt so viele O-Atome vor wie O2-Moleküle.
Bsp. 3:
Wasserstoff (H): 6.02 · 1023 H-Atome sind 1 g schwer (aus PSE), und 1 H-Atom ist 1 u schwer. Daraus lässt sich der Zusammenhang zwischen Unit (u) und Gramm (g) herleiten (vgl. Formel rechts).
Zusammenhang zwischen Unit (u) und Gramm (g): 1 u ist der 6.02 · 1023-zigste Bruchteil eines Gramms.
Aufgabe 1:
Übertrage die obige Definition zum Molbegriff (Kästchen) und die Beispiele 1 und 2 ins Journal.
Löse anschliessend die Aufgaben 2–4.
Die molare Masse
Rechnerisch die wichtigste Grösse ist die sogenannte molare Masse (M). Mithilfe der molaren Masse kann man letztlich in chemischen Reaktionen umgesetzte Stoffmengen berechnen oder chemische Formeln ermitteln:
Die molare Masse bezeichnet die Masse von 1 mol Stoff. Die Einheit ist [g/mol].
Zwischen der molaren Masse M und der Stoffmenge n sowie der Masse m besteht ein enger Zusammenhang:
M = m/n
Bsp. 1:
Wie gross ist die molare Masse von Magnesium?
1 einzelnes Mg-Atom = 24 u (aus PSE)
1 mol Mg-Atome = 24 g
Die molare Masse von Magnesium ist damit 24 g/mol.
(Du kannst die Zahl im PSE jeweils auf eine ganze Zahl auf- bzw. abrunden.)
Die Zahl 24.31 bei Magnesium lässt sich auch wie folgt lesen: 24.31 g/mol, d. h. 1 mol Mg-Atome sind 24.31 g schwer.
Bsp. 2:
Die molare Masse von Sauerstoff (O2): 2 · (16 g/mol) = 32 g/mol = M O2
Bsp. 3:
Die molare Masse von Methan (CH4): 12 g/mol + (4 · 1 g/mol) = 16 g/mol = M CH4
Bsp. 4:
Wie gross ist die Stoffmenge, die in 24 g Methan (CH4) enthalten ist?
M = m/n ⇒ n = m/M
= 24 g / (16 g/mol) = 1.5 mol = n CH 4
(Die Einheit g lässt sich wegkürzen.)
Natürlich geht das auch ohne Formel mit einem Dreisatz:
16 g = 1 mol | : 16
1 g = 1/16 mol | · 24
24 g = 24/16 mol = 6/4 mol = 1.5 mol
Aufgabe 5:
Übertrage die obige Definition zur molaren Masse (Kästchen) und die Beispiele 1 und 3 ins Journal.
Stöchiometrische Berechnungen
Bsp. 1: Verbrennung von Erdgas bzw. Methan (CH4)
Erdgas beziehungsweise Methan (CH4) verbrennt zu Kohlenstoffdioxid und Wasser. Wie viele Kilogramm Wasser entstehen bei der Verbrennung von 1 Kilogramm Erdgas?
Aufgabe 6:
Schau das obige Video (7:02 min) und übertrage das Schlussbild ins Journal.
Löse nun die restlichen Aufgaben ab Aufgabe 7.
Es liegen keine Dateien vor.
Die Aufgaben 1–11 müssen zwingend bearbeitet werden. Dafür hast du zwei Doppellektionen Zeit.
(Diese Aufgabe solltest du bereits bearbeitet haben.)
Übertrage die Definition zum Molbegriff (Kästchen) und die Beispiele 1 und 2 aus dem Theorieteil in dein Journal.
Das Mol ist eine Grösse für die Stoffmenge. Die Einheit ist [mol]. Die Teilchenmenge von 6.02 · 1023 Teilchen (rund 600 Trilliarden Teilchen) heisst Avogadro-Zahl und entspricht 1 mol.
6.02 · 1023 Teilchen (Atome, Moleküle) pro Mol = Avogadro-Konstante NA.
Bsp. 1:
- Die Grösse "Mol" kann man mit der Grösse "Dutzend" vergleichen. Ein dutzend Leute sind 12 Leute. 6 Leute entsprechen einem halben Dutzend Leuten.
- Analog sind:
- 1 mol Teilchen = 6.02 · 1023 Teilchen;
- 0.5 mol = 3.01 · 1023 Teilchen;
- 0.1 mol = 6.02 · 1022 Teilchen.
- Die Zahl 24.31 bei Magnesium im PSE lässt sich auch wie folgt lesen: 24.31 g/mol, d. h. 1 mol Mg-Atome sind 24.31 g schwer.
Bsp. 2:
- Sauerstoff (O): 16 g Sauerstoff (aus PSE) enthalten 6.02 · 1023 Sauerstoffatome.
- 16 g Sauerstoff entsprechen also 1 mol Sauerstoffatomen (O), aber nur 0.5 mol Sauerstoffmolekülen (O2), da es 2 O-Atome braucht, um ein O2-Molekül zu bilden.
(Bearbeite nun die Aufgabe 2.)
- Berechne die Stoffmenge von 5 · 1024 Eisenatomen.
(Die Stoffmenge wird jeweils in mol angegeben.)
- Berechne die Stoffmenge von 3.6 · 1022 Sauerstoffmolekülen.
Wie viele Dutzend sind 60 Stück?
Richtig, es sind 5 Dutzend. Im Prinzip rechnest du hier analog. Anstatt mit 12 pro Dutzend rechnest du einfach mit einem viel grösseren "Paket", nämlich: 6.02 · 1023/mol.
5 · 1024 : (6.02 · 1023)/mol = 8.31 mol Fe-Atome
(Achtung: Die Angabe von mehr als 2 Kommastellen ergäbe eine pseudogenaue Zahl. Ein Resultat kann nicht genauer sein als die zur Berechnung verwendeten Rohdaten. Hier ist die Avogadro-Zahl selbst schon eine auf 2 Kommastellen gerundete Zahl.)
(Bearbeite nun die Aufgabe 2b.)
3.6 · 1022 : (6.02 · 1023)/mol = 0.06 mol Sauerstoffmoleküle
(Auch hier: Mehr als 2 Kommastellen ergäbe eine pseudogenaue Zahl.)
(Bearbeite nun die Aufgabe 3.)
- Wie viele Teilchen enthalten 1.5 mol Wasser?
(Die Anzahl Teilchen wird ohne Einheit angegeben. Es handelt sich um eine "Stückzahl".)
- Wie viele Teilchen enthalten 2 mmol Kupfer?
(Hinweis: mmol = Millimol = 1/1000 mol = 10–3 mol)
1.5 mol · (6.02 · 1023)/mol = 9.03 · 1023 ≈ 9 · 1023 Wassermoleküle
(Bearbeite nun die Aufgabe 3b.)
2 · 10–3 mol · (6.02 · 1023)/mol = 1.20 · 1021 ≈ 1.2 · 1021 Cu-Atome
(Mehr als zwei Kommastellen bei der Zahl vor der Zehnerpotenz ergäbe eine pseudogenaue Zahl. Bei Zahlen vor einer Zehnerpotenz ist es sinnvoll, maximal eine Kommastelle anzugeben. So kann man schneller die Grössenordnung anhand der Zehnerpotenz erkennen. D. h., die Zehnerpotenz selbst hat einen wesentlichen grösseren Einfluss auf die Grösse der Zahl als die Zahl davor, hier "1.2".)
(Bearbeite nun die Aufgabe 4.)
Wie viele Atome kommen in 2 mol Stickstoffgas (N2) vor?
(Gib die Anzahl in mol an. Die absolute Anzahl von Teilchen ist meist uninteressant und ergibt unhandliche Zahlen.)
Wie viele C-Atome, H-Atome und O-Atome kommen in 3 Molekülen Traubenzucker (C6H12O6) vor?
Wie viele C-Atome, H-Atome und O-Atome kommen in 3 mol Traubenzucker (C6H12O6) vor?
(Gib die Anzahl wiederum in mol an.)
- Zeichne zuerst ein N2-Molekül im Kugelmodell.
Wie viele Atome hat also ein N2-Molekül?
Wie viele Atome liegen also in 1000 N2-Molekülen vor?
- Wie viele Atome liegen in 1 Dutzend bzw. in 2 Dutzend N2-Molekülen vor?
- Wie viele Atome liegen also in 1 mol bzw. in 2 mol N2-Moleküle (= Fragestellung)?
- Wie viele C-, H- und O-Atome hat es in 1 C6H12O6-Molekül? Wie sieht es dann bei 3 Molekülen aus?
- Wie viele C-, H- und O-Atome liegen in 1 mol C6H12O6-Molekülen vor? Wie sieht es dann bei 3 mol Molekülen aus?
In einem N2-Molekül kommt die doppelte Anzahl von Atomen vor.
- Die Formel N2 bedeutet, dass 1 N2-Molekül aus 2 N-Atomen besteht.
In 1000 N2-Molekülen kommen also 2000 N-Atome vor.
- 1 Dutzend N2-Moleküle entsprechen analog (immer das Doppelte) 2 Dutzend N-Atomen.
In 2 Dutzend N2-Molekülen kommen 4 Dutzend N-Atome vor.
- Da 1 mol N2-Moleküle = 2 mol N-Atome, folgt: 2 mol N2-Moleküle = 4 mol N-Atome
Traubenzucker-Molekül (C6H12O6) mit C-Atomen (schwarz), H-Atomen (weiss) und O-Atomen (rot).
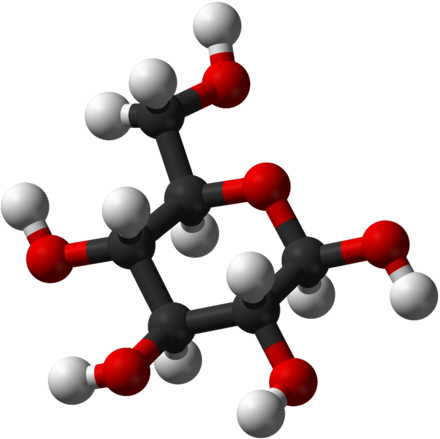
In einem C6H12O6-Molekül kommen 6 C-Atome, 12 H-Atome und 6 O-Atome vor.
In 3 C6H12O6-Molekülen kommen somit vor:
3 · 6 = 18 C-Atome
3 · 12 = 36 H-Atome
3 · 6 = 18 O-Atome
Traubenzucker-Molekül (C6H12O6) mit C-Atomen (schwarz), H-Atomen (weiss) und O-Atomen (rot).

In 1 mol C6H12O6 kommen 6 mol C-Atome, 12 mol H-Atome und 6 mol O-Atome vor.
In 3 mol C6H12O6 kommen somit vor:
3 · 6 = 18 mol C-Atome
3 · 12 = 36 mol H-Atome
3 · 6 = 18 mol O-Atome
(Fahre nun im Theorieteil weiter mit dem Kapitel Die molare Masse.)
(Diese Aufgabe solltest du bereits bearbeitet haben.)
Übertrage die Definition zur molaren Masse (Kästchen) und die Beispiele 1 und 3 aus dem Theorieteil in dein Journal.
Die molare Masse bezeichnet die Masse von 1 mol Stoff. Die Einheit ist [g/mol].
Zwischen der molaren Masse M und der Stoffmenge n sowie der Masse m besteht ein enger Zusammenhang:
M = m/n
Bsp. 1:
Wie gross ist die molare Masse von Magnesium?
1 einzelnes Mg-Atom = 24 u (aus PSE)
1 mol Mg-Atome = 24 g
Die molare Masse von Magnesium ist damit 24 g/mol.
(Du kannst die Zahl im PSE jeweils auf eine ganze Zahl auf- bzw. abrunden.)
Bsp. 3:
Wie gross ist die molare Masse von Methan (CH4)?
12 g/mol + (4 · 1 g/mol) = 16 g/mol = M CH4
(Fahre nun im Theorieteil weiter mit dem Kapitel Stöchiometrische Berechnungen.)
(Diese Aufgabe solltest du bereits bearbeitet haben.)
Erdgas beziehungsweise Methan (CH4) verbrennt zu Kohlenstoffdioxid und Wasser. Wie viele Kilogramm Wasser entstehen bei der Verbrennung von 1 Kilogramm Erdgas?
Schau das folgende Video (7:02 min) und übertrage das Schlussbild ins Journal.
Fülle die folgende Tabelle mithilfe des Periodensystems (PSE) aus:
| Element / Verbindung | Chemische Formel | Atom- bzw. Molekülmasse [u] | Molare Masse [g/mol] | Stoffmenge in 4 g Stoff [mol] |
|---|---|---|---|---|
| Helium: | ||||
| Wasserstoffmoleküle: | ||||
| Wassermoleküle: |
- Runde jeweils die Zahlen aus dem PSE auf ganze Zahlen.
- Letzte Spalte: Schreibe nicht nur das Resultat hin, sondern auch die Rohdaten mit Einheiten.
- Wenn du bei Berechnungen jeweils konsequent die Einheiten hinschreibst, kannst du überprüfen, ob das Resultat eine passende (logische) Einheit hat. Eine Einheit wie g2/mol ergäbe z. B. wenig Sinn.
- Umgekehrt erhält man z. B. durch die Rechenoperation [g] : [g/mol] die Einheit mol, was Sinn ergibt, wenn – wie in der letzten Spalte – eine Stoffmenge gefragt ist.
| Element / Verbindung | Chemische Formel | Atom- bzw. Molekülmasse [u] | Molare Masse [g/mol] | Stoffmenge in 4 g Stoff [mol] |
|---|---|---|---|---|
| Helium: | He | 4 u | 4 g/mol | 4 g : 4 g/mol = 1 mol |
| Wasserstoffmoleküle: | H2 | 2 u (1 u + 1 u) | 2 g/mol | 4 g : 2 g/mol = 2 mol |
| Wassermoleküle: | H2O | 18 u (2 · 1 u + 16 u) | 18 g/mol | 4 g : 18 g/mol = 0.22 mol |
Wie gross ist die Masse von 0.25 mol Ammoniak (NH3)?
- Die Masse wird in g angegeben.
- Überlege dir zuerst, wie schwer 1 einzelnes NH3-Molekül, dann wie schwer 1 mol NH3-Moleküle sind.
- Im letzten Schritt ist zu vergleichen, wie 1 mol zur gesuchten Stoffmenge von 0.25 mol steht.
Mit "Zweisatz" (0.25 ist 4-mal weniger als 1):
1 mol NH3 = 17 g | : 4
0.25 mol NH3 = 4.25 g
Alternativ mit "Einheiten verrechnen":
0.25 mol · 17 g/mol = 4.25 g
Welcher Stoffmenge entsprechen 100 g Gold?
- Die Stoffmenge wird in mol angegeben.
- Überlege dir zuerst, wie schwer 1 einzelnes Goldatom ist, dann wie schwer 1 mol Goldatome sind.
- Im letzten Schritt ist die Masse von 1 mol Gold mit der gegebenen Masse von 100 g zu vergleichen.
Mit Dreisatz:
197 g Gold = 1 mol | : 197 (auf 1 g runterrechnen)
1 g Gold = 1/197 mol | · 100 (ges.: 100 g)
100 g Gold = (1/197) · 100 mol = 0.51 mol Goldatome
Alternativ mit "Einheiten verrechnen":
100 g : 197 g/mol = 0.51 mol Goldatome sind in 100 g Gold enthalten.
Wie viele g Sauerstoff (O2) werden verbraucht, wenn man 18 g Aktivkohle (C) vollständig zu Kohlenstoffdioxid (CO2) verbrennt?
(Um diese Aufgabe lösen zu können, musst du zuerst die Reaktionsgleichung aufstellen.)
- Die Reaktionsgleichung lautet: C + O2 → CO2
- Aus der Reaktionsgleichung kann man entnehmen, dass für die Reaktion von 1 mol Kohlenstoff (C) auch 1 mol Sauerstoff (O2) benötigt wird.
- Die gegebenen 18 g Kohlenstoff sind jedoch mehr als 1 mol Kohlenstoff. Wie viel mal mehr?
- Orientiere dich am Musterbeispiel (Aufg. 6), welches du in deinem Journal festgehalten hast.
Welche Masse Sauerstoff benötigst du für die Reaktion mit 18 g Kohlenstoff (vgl. Aufgabe 10), wenn anstelle von Kohlenstoffdioxid Kohlenstoffmonoxid (CO) als Produkt entsteht?
Welche Masse Kohlenstoffmonoxid (CO) entsteht dabei?
- Was fällt auf, wenn du die Summe der Massen der zwei Edukte C und O2 mit der eben unter (b) berechneten Masse des Produkts CO vergleichst?
- Die Reaktionsgleichung lautet nun: 2 C + O2 → 2 CO
- Aus der Reaktionsgleichung kann man somit entnehmen, dass für die Reaktion von 2 mol Kohlenstoff (C) nur 1 mol Sauerstoff (O2) benötigt wird, wobei 2 mol Kohlenstoffmonoxid (CO) entstehen.
- Die gegebenen 18 g Kohlenstoff sind jedoch weniger als 2 mol Kohlenstoff. Wie viel mal weniger?
- Orientiere dich am Musterbeispiel (Aufg. 6), welches du in deinem Journal festgehalten hast.
(Du kannst hier die Antwort zur Aufg. 11a einfach ergänzen und die Überschrift zur Aufgabe 11 anpassen.)
(Auch hier kannst du die Antwort zur Aufg. 11b einfach ergänzen und die Überschrift zur Aufgabe 11 anpassen)
(Die experimentell beobachtbare Massenerhaltung bei chemischen Reaktionen liess den Schluss zu, dass bei einer chemischen Reaktion Atome bloss umgruppiert und nicht etwa verbraucht werden oder verloren gehen.)
Wie viele kg Ammoniak (NH3) entstehen, wenn 6 kg Wasserstoff (H2) mit einer genügenden Menge von Stickstoff (N2) reagieren?
- Die Reaktionsgleichung lautet: 3 H2 + N2 → 2 NH3
- Aus der Reaktionsgleichung kann man somit entnehmen, dass für die Synthese von 2 mol Ammoniak (NH3) 3 mol Wasserstoff (H2) benötigt werden.
- Die gegebenen 6 kg Wasserstoff sind jedoch mehr als 1 mol Wasserstoff. Wie viel mal mehr?
- Orientiere dich am Musterbeispiel (Aufg. 6), welches du in deinem Journal festgehalten hast.
Für die Reaktion von 111.7 g Eisen zu einem Eisenoxid wird genau 48.03 g Sauerstoff verbraucht. Wie lautet die Formel von diesem Eisenoxid?
(Rechne hier für einmal nicht mit den auf ganze Zahlen gerundeten, sondern mit den genauen Atommassen aus dem PSE.)
- Berechne, welcher Stoffmenge [mol] die zwei Massenangaben [g] entsprechen.
- Ein Vergleich der zwei berechneten Stoffmengen lässt das anzahlmässige Verhältnis der Fe- und O-Atome in dem Eisenoxid erkennen.
Anzahl Fe-Atome: 111.7 g : 55.85 g/mol = 2 mol
Anzahl O-Atome: 48.03 g : 16.01 g/mol = 3 mol
Auf 2 Fe-Atome kommen somit 3 O-Atome (Verhältnis 2 : 3), womit die Formel des Eisenoxids lautet: Fe2O3
Welche Stoffprobe enthält mehr Teilchen: 5 g Argon (Ar) oder 5 g Stickstoff (N2)?
- Beachte, dass – im Unterschied zu Argongas – die kleinsten Teilchen in Stickstoffgas Moleküle darstellen (N2).
- Halte den Lösungsweg fest (im Lösungsteil ist absichtlich nur das Resultat aufgeführt).
- Melde dich bei der Lehrperson, wenn du nicht auf dieselben Zahlen wie in der Lösung kommst.
5 g Argon enthalten weniger Teilchen (0.13 mol Ar-Atome) als 5 g Stickstoff (= 0.18 mol N2-Moleküle).