CP 3 Teilchenmodell (Theorie)
Das Teilchenmodell – Stoffe bestehen aus kleinsten Teilchen
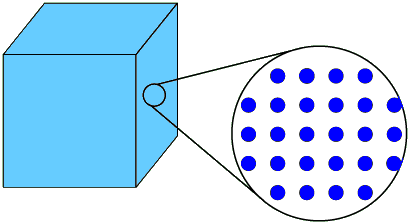
In diesem Kapitel stellen wir uns die Frage, wie Stoffe aufgebaut sind und wie wir uns beispielsweise vorstellen können, was beim Verdampfen von Wasser passiert. Dazu werden wir ein erstes Modell kennenlernen.
Gehen wir von folgendem Gedanken-Experiment aus: Du nimmst einen Tropfen Wasser auf deinen linken Zeigefinger. Diesen Tropfen berührst du anschliessend mit deinem rechten Zeigefinger. Der Tropfen ist nun etwas kleiner geworden. Nun trocknest du deinen linken Zeigefinger und berührst mit diesem anschliessend wieder den Tropfen auf deinem rechten Zeigefinger. Der Tropfen wird dadurch immer kleiner. Wie lange kann dieses Experiment weiter fortgeführt werden? Mit solchen Gedankenspielen haben sich bereits im 5. Jahrhundert v. Chr. die griechischen Philosophen Demokrit und Leukipp befasst. Demokrit hat vermutet, dass alle Stoffe aus kleinsten Teilchen bestehen. Folglich lässt sich das Wassertropfen-Experiment im Prinzip so lange fortsetzen, bis nur noch ein Teilchen Wasser da ist.

Demokrit (Quelle: Wikipedia).
Das Problem ist nun aber, dass dieses einzelne Wasserteilchen äusserst klein ist. So klein, dass es bis heute noch nicht gelungen ist, ein solches Teilchen genau zu sehen. Das bedeutet, dass wir uns die Gestalt ein solches Teilchens nur vorstellen können. Eine solche Vorstellung der realen Welt nennen wir Modell. Demokrit stellte sich diese Teilchen als unterschiedlich geformt, aber unveränderlich vor. Vereinfachend nehmen wir an, dass diese Teilchen kugelförmig sind. Das Teilchenmodell macht dabei folgende Aussagen:
- Alle Stoffe bestehen aus kleinsten, kugelförmigen Teilchen.
- Zwischen den Teilchen ist leerer Raum
- Die Teilchen eines sogenannten Reinstoffs (vgl. später) sind unter sich gleich, Gemische bestehen aus verschiedenen Teilchenarten.
- Unter sich gleiche Teilchen sind in ihrer Gesamtheit für die spezifischen Stoffeigenschaften eines Reinstoffs verantwortlich.
- Zwischen den Teilchen wirken Anziehungskräfte, die mit dem Abstand schnell kleiner werden.
- Die Teilchen sind ständig in Bewegung. Je höher die Temperatur eines Stoffs ist, desto grösser ist die durchschnittliche Geschwindigkeit seiner Teilchen.
Mit dem Teilchenmodell lassen sich eine ganze Anzahl von Phänomenen überzeugend gut erklären, zum Beispiel:
- Übergang eines Stoffes vom festen Zustand zum flüssigen respektive gasförmigen Zustand (Aggregatzustandsänderung)
- Lösevorgänge und Kristallisation von Stoffen
- Die spontane Ausbreitung von Stoffen, z. B. von Parfumduft in der Luft (Diffusion)
- Die Zitterbewegung von Tröpfchen oder Partikeln, z. B. von Tabakpartikeln in der Luft (Brownsche Bewegung)
- Die Wärmeübertragung von einem Stoff zu einem anderen, z. B. von heissem Tee auf die umgebende Tasse (Wärmeleitung)
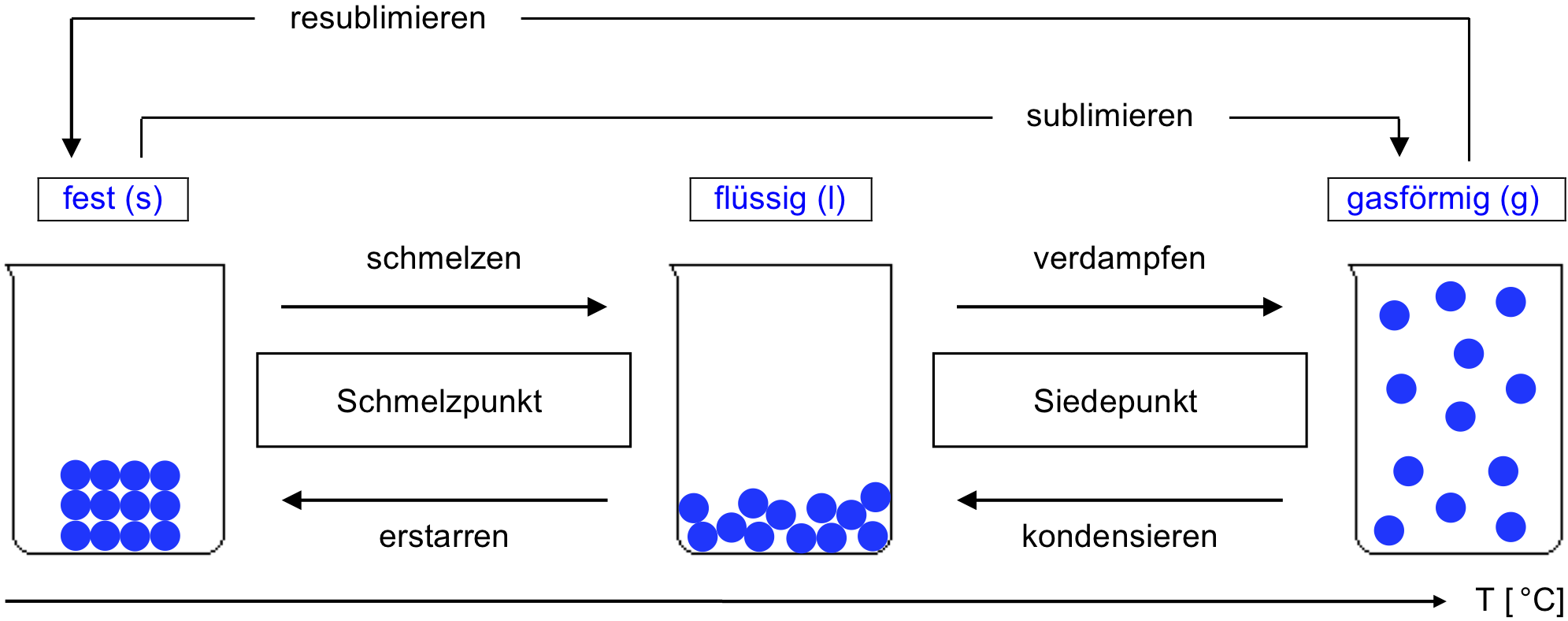
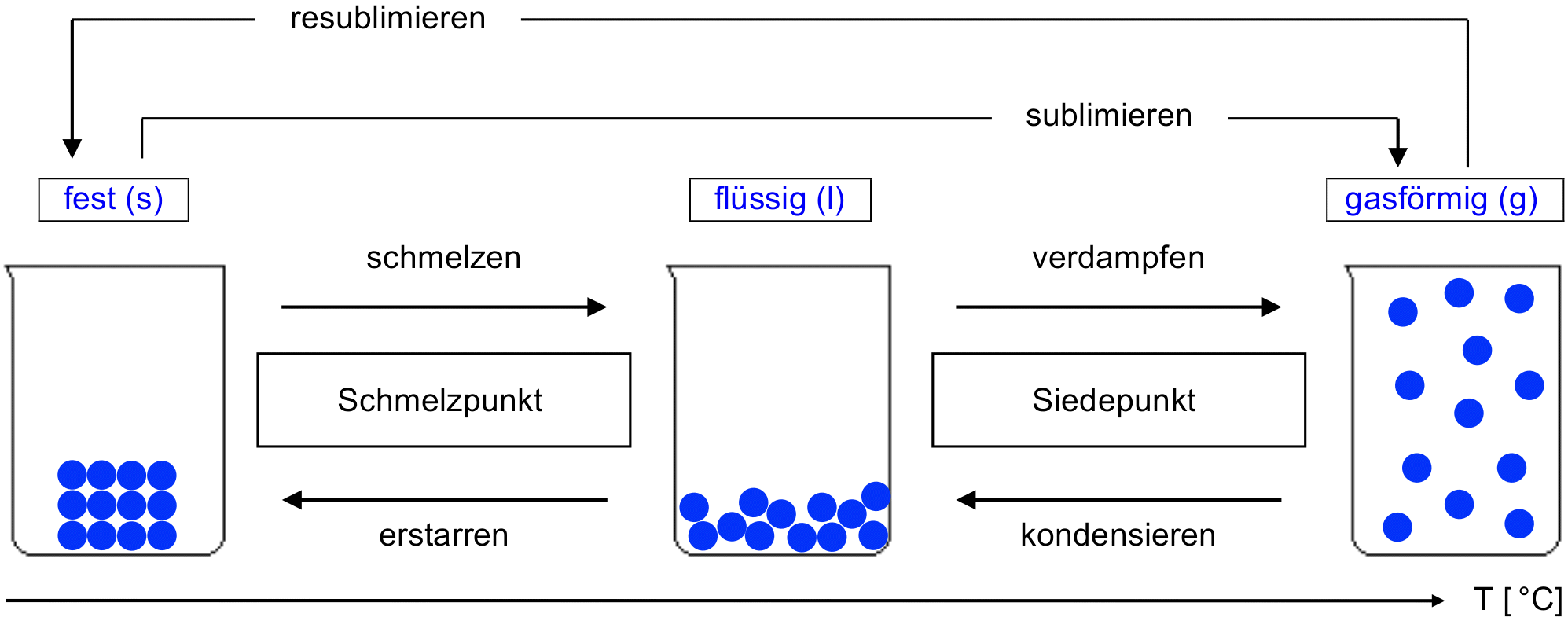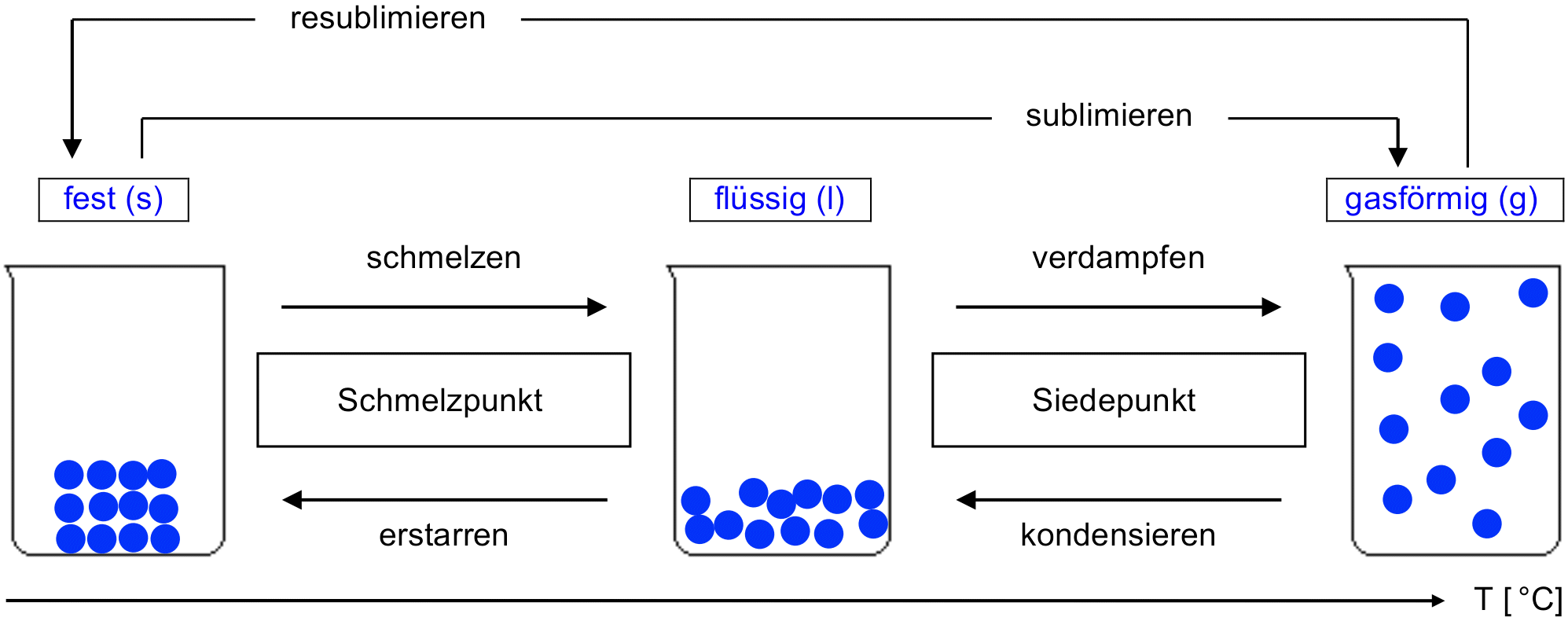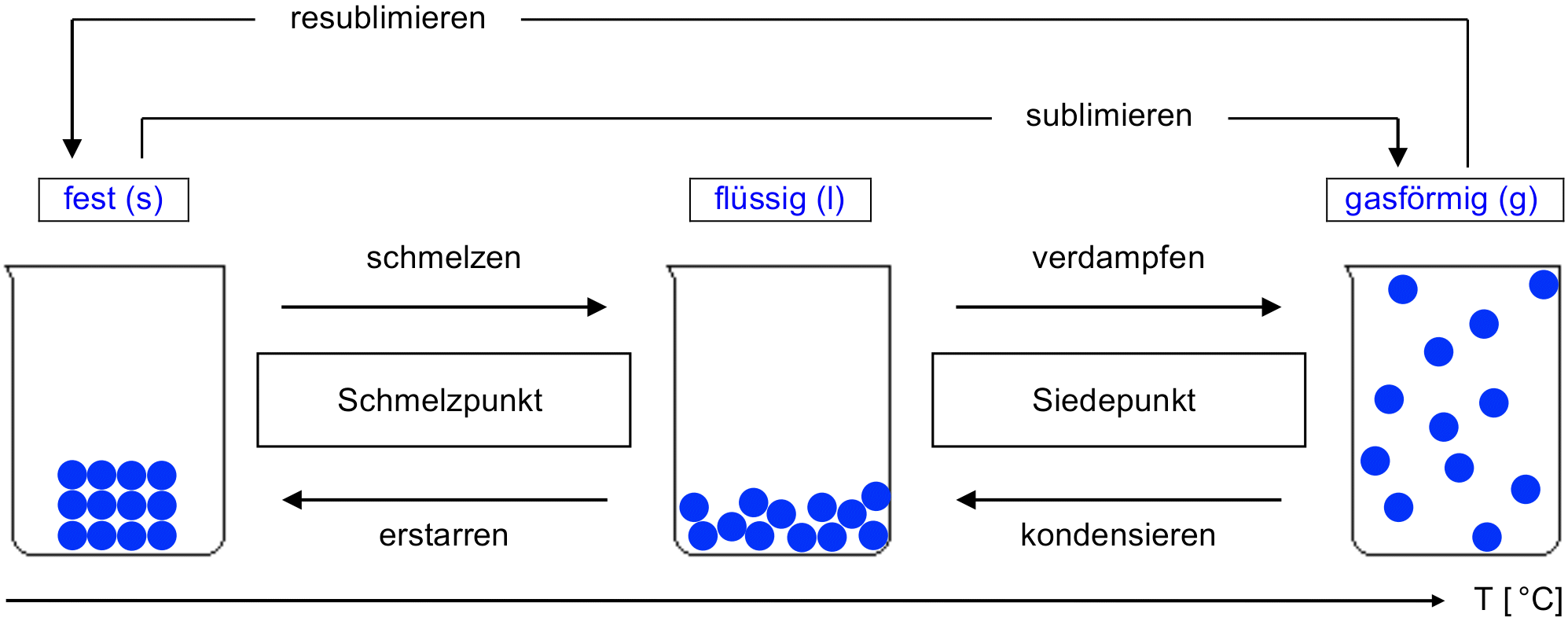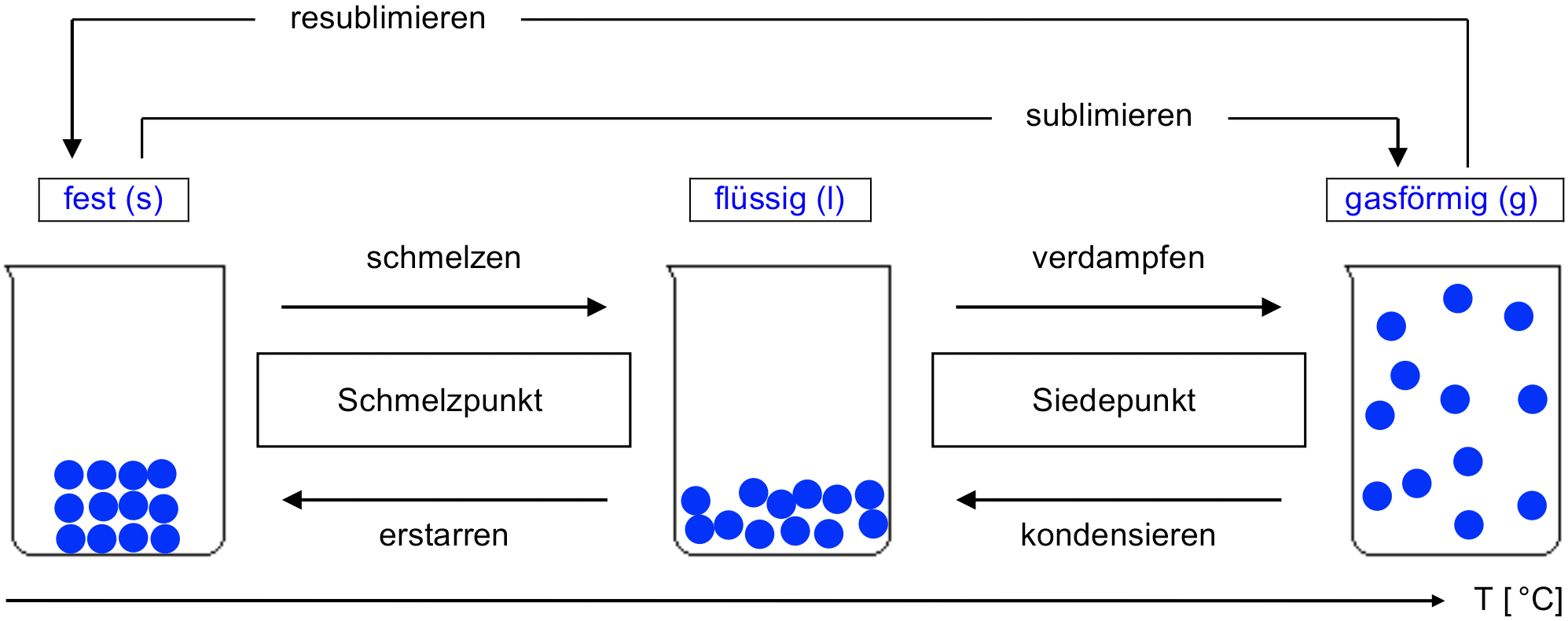
Die drei Aggregatzustände
Aus Erfahrung wissen wir, dass Stoffe ihre Zustandsform ändern können. Ein bekanntes Beispiel aus dem Alltag sind die drei Zustandsformen von Wasser: Eis, Wasser im engeren Sinn, Wasserdampf. Die drei Zustandsformen sind also 'fest', 'flüssig' und 'gasförmig'.
Aufgabe 1:
Das folgende Video zeigt, was beim Erhitzen eines Feststoffs (z. B. Eis) bis zum Gas und anschliessendes Abkühlen des entstandenen Dampfs (z. B. Wasserdampf) zurück zum Feststoff (im Bsp. Eis) passiert.
- Halte in deinem Journal mit einer Skizze, basierend auf dem untenstehenden Schema, fest, wie die 3 Aggregatzustände mit dem Teilchenmodell wiedergegeben werden können. Gib deiner Skizze eine sinnvolle Überschrift.
- Vorgegeben ist dabei ganz links ein Becherglas, in dem sich ein Eiswürfel aus 12 Wasserteilchen befinden soll.
- Verwende ein Bleistift zum Zeichnen der Kugeln. Sei präzise beim Zeichnen, damit man genau das aus deiner Skizze erkennen kann, was in der untenstehenden Tabelle in Worten festgehalten ist (diese kannst du nach dem Video studieren).
- Ergänze die Lücken (Pfeile, Kästchen) im Schema, d. h., wie bezeichnet man jeweils die Übergänge von einem Aggregatzustand zum nächsten?
- Schau nun dieses tonlose Video (nanoo.tv, 4:02 min).
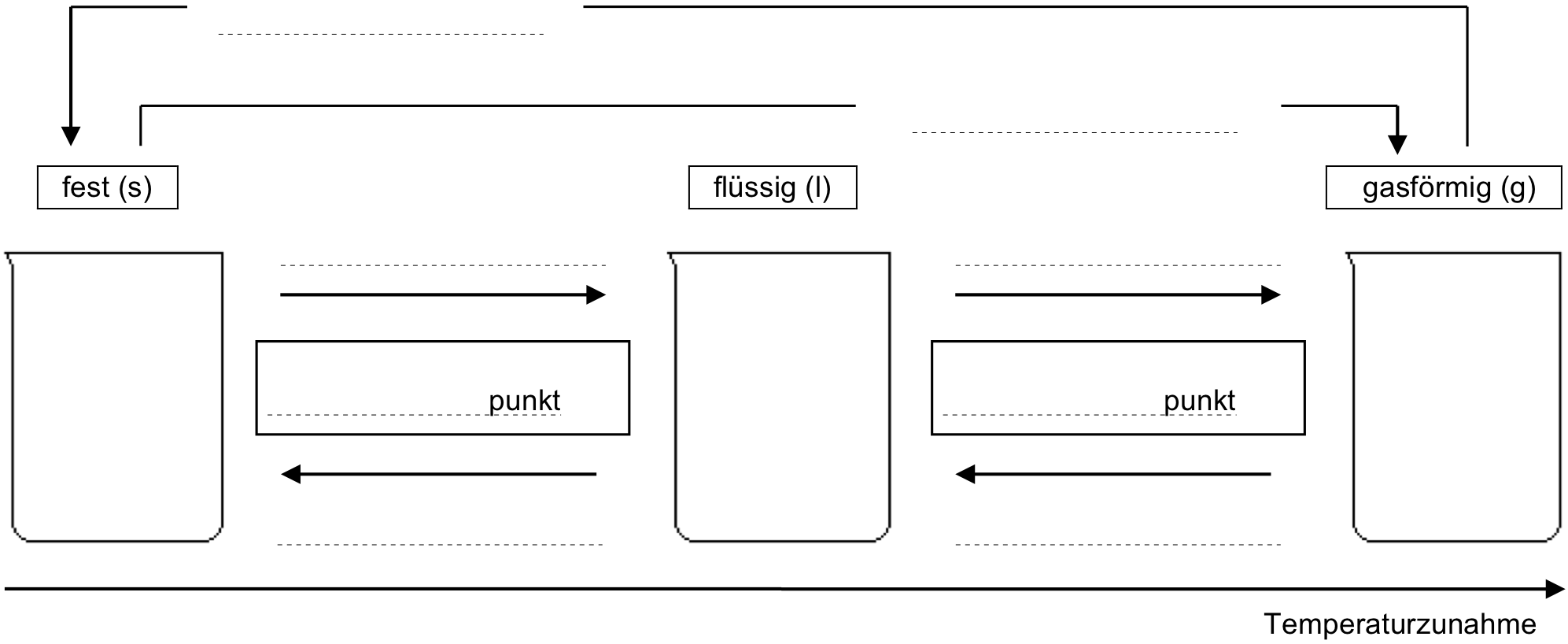
Tabelle: Beschreibung der drei Aggregatzustände mit dem Teilchenmodell
| Feststoff | Flüssigkeit | Gas | |
|---|---|---|---|
| Anziehungskraft zwischen Teilchen: |
|
|
|
| Abstand zwischen Teilchen: |
|
|
|
| Ordnungsgrad der Teilchen: |
|
|
|
| Freiheitsgrad der Teilchenbewegung: |
|
|
|
| Verformbarkeit des Stoffes: |
|
|
|
Bemerkung zum Begriff "Wasserdampf"

"Wasserdampf" in der Alltagssprache: Damit sind feinstverteilte Tröpfchen kondensierten Wassers in der Luft (= Nebel) gemeint. (Quelle: Wikipedia, modifiziert).

"Wasserdampf" in der Fachsprache, d. h. im engeren Sinn: Gasförmige Form von Wasser, welche farblos und damit unsichtbar ist. (Quelle: Wikipedia).
Spezialfall "Sublimation und Resublimation"

Rauhreif an Bäumen in einem Forst: Aus Luft mit hoher Luftfeuchtigkeit, d. h. mit hohem Anteil an Wasserdampf, kann bei Abkühlung direkt festes Wasser (Eis) entstehen, ohne dass flüssiges Wasser in Erscheinung tritt; es liegt also eine Resublimation vor: Wasser (g) → Wasser (s). (Quelle: Wikipedia, modifiziert).

Eisblumen, eine besondere Form von Rauhreif an einem Fenster: Auch hier entsteht das Eis aus Resublimation von Wasserdampf. Umgekehrt kann Sublimation von festem Wasser zu Wasserdampf auftreten, wenn eine feine Eisfläche im Garten (gefrorene Pfütze) – über einen Zeitraum von mehreren Tagen mit Temperaturen unter 0 °C – langsam wieder verschwindet, ohne dass je flüssiges Wasser zu sehen ist. (Quelle: Wikipedia).
Bei der Aufgabe 2 wirst du dich mit der Sublimation und Resublimation von Iod beschäftigen – einem Stoff, der bei Zimmertemperatur fest und im Unterschied zu Wasser farbig ist. Kontrolliere zuerst deine Lösung zur Aufgabe 1 und bearbeite im Anschluss die Aufgaben 2–5.
Diffusion – Teilchen verteilen sich ohne äusseres Zutun
(Dieses Kapitel sollte erst nach dem Lösen der Aufgaben 1–5 bearbeitet werden.)
Zwei Gase vermischen sich auch dann, wenn das spezifisch schwerere (also das dichtere) Gas unten (Bsp.: Brom), das spezifisch leichtere Gas oben ist (Bsp.: Luft – vgl. Abbildung rechts). Diese selbsttätige Ausbreitung geht solange vor sich, bis sich alle Gasteilchen im zur Verfügung stehenden Raum gleichmässig verteilt haben. Eine analoge Ausbreitung ist auch bei Stoffen zu beobachten, die in Flüssigkeiten gelöst sind (vgl. Aufgabe 4: Kaliumpermanganat in Wasser). Dieser hier beschriebene Vorgang heisst Diffusion:
Selbsttätige Ausbreitung von Teilchen im zur Verfügung stehenden Raum, was zu gleichmässiger Verteilung der Teilchen im entsprechenden Volumen führt.
Die Diffusion beruht auf der Eigenbewegung (Wärmebewegung) von Teilchen. Diese Eigenbewegung ist regellos und ungeordnet: Ein einzelnes Teilchen bewegt sich dabei geradlinig und ändert seine Richtung nur beim Zusammenstoss mit einem anderen Teilchen (vgl. Abbildung rechts). Die Diffusion von Teilchen ist in der Biologie von enormer Bedeutung. In Zellen hinein werden gewisse Substanzen durch Diffusion transportiert, was die Zelle keine Energie kostet.
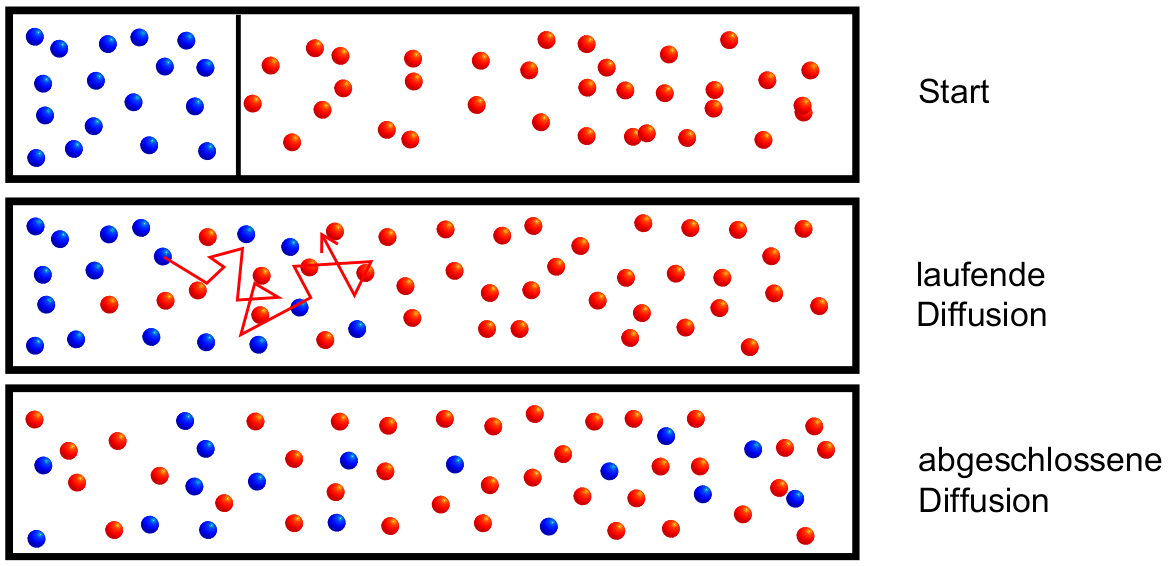
Vermischung zweier Gase (rot: z. B. Brom; blau: z. B. Luft) durch Diffusion im Teilchenmodell. Nach vollendeter Diffusion liegt überall die gleiche Bromkonzentration vor. (Quelle: Wikipedia, modifiziert).
Leider können wir die Diffusion im Alltag selten wahrnehmen. In den folgenden zwei Beispielen tritt zwar Diffusion auf, praktisch ist sie jedoch in den spezifischen Fällen nicht relevant:
- Wenn wir ein paar Tropfen Parfüm in eine Zimmerecke träufeln, so erfüllt der Duft schliesslich nach geraumer Zeit das ganze Zimmer, auch ohne Luftzug.
- Auch der Kaffee wird nach Zugabe eines Würfelzuckers süss, auch wenn wir nicht rühren. Wir müssen nur genug lange warten.
Luftzug und Rühren verteilen in der Praxis die Teilchen viel schneller als die Diffusion. Die Diffusion ist nur über kleine Strecken wirkungsvoll und von Bedeutung, eben zum Beispiel in Zellen.
Brownsche Bewegung
Die Eigenbewegung der Teilchen kann indirekt zum Beispiel sichtbar gemacht werden, wenn man Tabakrauch unter dem Mikroskop beobachtet: Die im Rauch befindlichen, grossen (und damit sichtbaren) Russpartikel befinden sich in permanenter, zitternder Bewegung, da sie von den Stössen der nicht sichtbaren (viel kleineren) Gasteilchen andauernd Richtungsänderungen erfahren. Die schnelle Wärmebewegung von Flüssigkeits- oder Gasteilchen bewirkt also durch häufige Stösse die wesentlich langsamere, unter dem Mikroskop beobachtbare Brownsche Bewegung grösserer sichtbarer Partikel oder Tröpfchen. Mit diesem Modell konnte auch die im Jahre 1827 vom schottischen Botaniker Robert Brown gemachte Beobachtung erklärt werden, der feststellte, dass in einem Wassertropfen verteilte Bruchstücke von Pollenkörnern unter dem Mikroskop sich ruckartig hin und her bewegten.
Modell für die Brownsche Bewegung (Video, ohne Ton): Ein unter dem Mikroskop sichtbares Partikel (gelb: z. B. Russpartikel im Tabakrauch) bewegt sich wirr hin und her (= Brownsche Bewegung), ausgelöst durch Stösse unsichtbarer Teilchen (schwarz: im Bsp. Luftteilchen). Quelle: National Taiwan Normal University (YouTube).
Lösevorgänge
Bsp.: Ein Feststoff (z. B. Zucker) wird in einem Lösungsmittel (z. B. Wasser) gelöst.
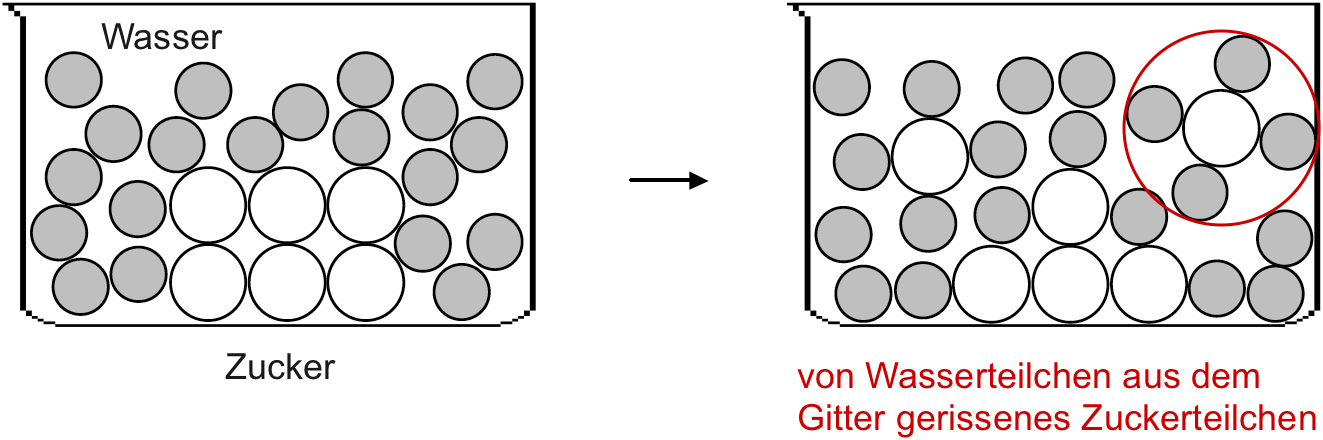
Das Lösen von Zucker in Wasser im Teilchenmodell
Infolge ihrer Eigenbewegung treffen Wasserteilchen nicht nur auf ihresgleichen, sondern auch auf Zuckerteilchen. Die Wasserteilchen und die Zuckerteilchen ziehen sich an. Wasserteilchen lagern sich an die Zuckerteilchen an. Besonders an den Ecken und Kanten werden dabei die Zuckerteilchen aus dem Verband – d. h. aus dem Gitter – herausgeschlagen. Wasserteilchen lagern sich vollständig um jedes Zuckerteilchen an (vgl. rot eingekringelt in der obigen Abbildung). Der Stoff wird gelöst.
In einer bestimmten Menge Lösungsmittel kann man nicht beliebig viel Stoff lösen. Wenn bei einer gegebenen Temperatur ein Maximum an Stoff gelöst ist, so bezeichnet man die Lösung als gesättigte Lösung.
Die meisten Stoffe lösen sich bei Temperaturerhöhung besser, da die Teilchenbewegung (Geschwindigkeit) bei Erwärmung zunimmt: Zucker löst sich zum Beispiel in kalter Milch viel schlechter als in heisser Milch.
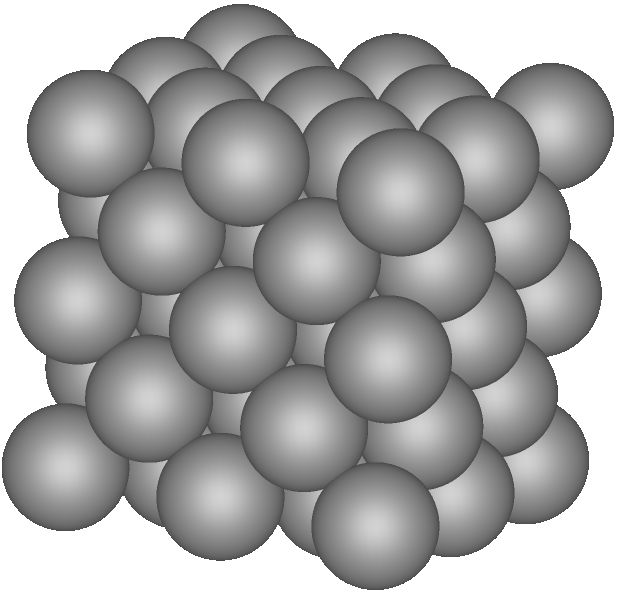
Kristallisation
Kristalle, welche durch ihre charakteristische Formen (Ordnung!) gekennzeichnet sind, entstehen:
- beim Erstarren von geschmolzenen Stoffen: z. B. Wasser (l) → Wasser (s)
- beim Resublimieren von Gasen: z. B. Iod (g) → Iod (s)
- beim Auskristallisieren aus gesättigten Lösungen: z. B. Kochsalz (gelöst) → Kochsalz (s), vgl. CP 1
In allen Fällen werden zwischen den Teilchen starke Anziehungskräfte wirksam. Die Anziehungskräfte bewirken, dass die Teilchen räumlich regelmässig angeordnet werden. Es entstehen Kristallgitter. Im Falle von Kochsalz (Natriumchlorid) sind das immer würfelförmige Kristalle (vgl. neben stehende Abbildung).
Die Kristallisation aus Lösungen können wir als Umkehrvorgang des Lösens eines Stoffes in einem Lösungsmittel verstehen.
Was ist ein Modell?
Wegen ihrer äusserst geringen Grösse kann man die kleinsten Teilchen eines Stoffs mit optischen Mitteln (Lupe, Lichtmikroskop) nicht erkennen. Wir können diese Teilchen nicht wirklichkeitsgetreu abbilden. Eigenschaften und Reaktionen eines Stoffs sind jedoch auf dessen spezifischen Aufbau (aus Teilchen) zurückzuführen. Zur Erklärung von Eigenschaften und Reaktionen braucht man also trotzdem ein Bild dieser unsichtbaren Teilchenwelt. Aus diesem Grund wurden Vorstellungen (Modelle) über den Aufbau von Stoffen entwickelt. Die Annahme kleinster Teilchen kugelförmiger Gestalt ist eine solche Modellvorstellung von Materie. Man spricht deshalb auch vom Kugelteilchenmodell. Neben dem Teilchenmodell ist das Atommodell (vgl. später) ein weiteres bekanntes Modell.
Ein Modell dient zur Erklärung von Beobachtungen. Ein Modell ist nicht richtig oder falsch. Es ist brauchbar oder unbrauchbar, um einen Vorgang, eine Eigenschaft erklären zu können. In der Folge können je nach Eigenschaft, welche man erklären will, mehrere Modelle zum Einsatz kommen. Ein Modell gibt höchstens einen Teil der Wirklichkeit annähernd wieder.
Sachverhalt
(z. B.: Anordnung der Teilchen in einem Kristall)
- abstrakt
- kompliziert
- unsichtbar
- übersteigt Vorstellungsvermögen
An einem guten Modell können sogar Eigenschaften vorausgesagt werden, die man noch gar nicht beobachten respektive nachweisen konnte. Findet man diese Eigenschaften tatsächlich, so ist das ein Beweis dafür, dass das Modell brauchbar ist.
Modell
(Modellvorstellung: Gittermodell mit Kugeln)
- vereinfacht
- veranschaulicht Zusammenhänge
- reduziert auf das Wesentliche
Bearbeite nun die restlichen Aufgaben ab Aufgabe 6.
Es liegen keine Dateien vor.
Im Rahmen des CPs sollten sicher die Aufgaben 1–5 bearbeitet werden können.
Die restlichen Aufgaben 6–9 sind als Hausaufgaben zu bearbeiten.
(Diese Aufgabe solltest du bereits bearbeitet haben. Hier geht's zur Lösung.)
Gib die drei Aggregatzustände mit dem Teilchenmodell wieder und bezeichne jeweils die Übergänge zwischen den Aggregatzuständen mit den entsprechenden Begriffen.
Gib die Vorgänge beim Erhitzen und Abkühlen von Iod, die in folgendem Video gezeigt werden, mit dem Teilchenmodell wieder.
Lies die folgenden Punkte vor dem Schauen des nachfolgenden Videos durch:
- Halte in deinem Journal mit einer Skizze den Versuchsaufbau fest, wobei du den Stoff Iod – für die 3 Phasen des Experiments (Start, Erhitzen, Ende) in der gleichen Abbildung – mit dem Teilchenmodell wiedergibst. Gib deiner Skizze wiederum eine sinnvolle Überschrift.
- Verwende wiederum ein Bleistift zum Zeichnen der Kugeln. Sei präzise beim Zeichnen.
- Vorgegeben ist dabei ein Becherglas, in dem sich der Einfachheit halber bloss ein Iodkorn (1 Iodkristall) befinden soll.
- Beschrifte deine Skizze und halte für die beobachteten Aggregatzustände von Iod die jeweilige Abkürzung "Iod (?)" sowie die Eigenschaften "Farbe", "Form" und "Glanz" fest.
- Welche Aggregatzustandsform konnte nicht beobachtet werden und was ist deren Abkürzung?
- Setze nun die Kopfhörer auf und schau das folgende Video:
Quelle: YouTube (Video, 1:18 min).
Versuch: Bromgas am Boden eines Zylinders
Beschreibe die Beobachtungen, die in folgendem Video zu machen sind, in Worten und mit dem Teilchenmodell (Skizze).
- Zeichne die zwei Zylinder zu Beginn und bei Abschluss des Experiments und stelle den Stoff Brom im Teilchenmodell dar (die Luftteilchen werden also weggelassen). Gib deiner Skizze wiederum eine sinnvolle Überschrift.
- Vergleiche am Ende des Experiments die Farbe des Gases in unteren mit dem oberen Zylinder.
- Vergleiche die Farbe des Gases zu Beginn des Experiments mit der Farbe am Ende des Experiments.
- Wie erklärst du die die Beobachtungen unter (2) und (3)?
Quelle: YouTube (Video, 32 sec).
Das orange Bromgas breitet sich von alleine in Richtung des zweiten Zylinders aus. Nach ca. 1 Stunde – also am Ende des Experiments – hat sich das Gas regelmässig verteilt, da in beiden Zylindern das Gas gleich intensiv orange erscheint. Im Vergleich zu Beginn des Experiments ist das Gas jedoch leicht heller, da die gleiche Anzahl Bromteilchen nun das doppelte Volumen einnimmt, womit sich die Konzentration von Brom halbiert hat.
Versuch: Kaliumpermanganat (ein violettes Salz) am Boden eines Zylinders mit Wasser.
Beschreibe die Beobachtungen, die in folgendem Video zu machen sind, in Worten und mit einer Skizze.
- Halte mit einer Skizze die Farbverteilung im Zylinder bei Start und am Ende des Experiments fest (für einmal nicht mit dem Teilchenmodell).
- Beschreibe den Vorgang in Worten.
- Beschreibe die Ausbreitungsgeschwindigkeit eines Stoffs in einer Flüssigkeit im Vergleich zur Ausbreitungsgeschwindigkeit eines Gases.
- Wie kann man die Beobachtung bei (3) mit dem Teilchenmodell begründen?
Quelle: YouTube (Video, 1:35 min).
Das violette Salz breitet sich im Zylinder von unten nach oben aus. Nach 5 Wochen ist die Wassersäule überall gleich intensiv violett gefärbt (gleiche Konzentration des violetten Salzes). Die Ausbreitungsgeschwindigkeit von Stoffen ist in Flüssigkeiten deutlich langsamer als in Gasen, da sich die Teilchen in Flüssigkeiten sehr viel weniger schnell bewegen als in Gasen.
(Bearbeite nun die Aufgabe 5.)
Eigenbewegung von Teilchen und deren Temperaturabhängigkeit
Mache dir mithilfe der folgenden Animation klar, wie man sich die Eigenbewegung der Teilchen vorstellt und wie diese von der Temperatur abhängt.
- Für die selbsttätige Ausbreitung von Kaliumpermanganat in Wasser und von Brom in einem Zylinder ist die Eigenbewegung der Teilchen verantwortlich. Wir betrachten nun die Eigenbewegung der Teilchen in einem Gas. Stelle dazu in der Animation auf dieser Webseite die Regler wie unten dargestellt ein (rot eingerahmt):
(Damit du diese Einstellungen effizient vornehmen kannst, kannst du mit den Tastaturbefehlen "Ctrl+Tab" und "Ctrl+Umschalt+Tab" zwischen den Browser-Tabs (CP-Webseite und externe Webseite) wechseln. Noch einfacher geht's mit "Ctrl+PageUp" "Ctrl+PageDown", falls das dein Gerät unterstützt.)
- Stelle nun die Heizeinheit (Heater) ein (grüne Markierung oben).
- Stelle die Temperatur aufs Minimum (grün eingerahmter Regler unten) und warte einige Sekunden.
- Betrachte ein einzelnes Gasteilchen und beschreibe dessen Bewegung.
- Stelle die Temperatur nun aufs Maximum und warte wiederum einige Sekunden.
- Beschreibe die Temperaturabhängigkeit der Eigenbewegung in 1 Satz.

Die Teilchen bewegen sich geradlinig fort, bis sie auf ein anderes prallen und die Richtung ändern. Insgesamt ist die Bewegung der Teilchen ungerichtet. Je höher die Temperatur, desto schneller bewegen sich die Teilchen.
(Gehe nun zurück zur Theorie.)
(Die folgenden Aufgaben kannst du erst bearbeiten, nachdem du die restliche Theorie studiert hast.)
Diffusion eines gelben Farbstoffs
In welchem der zwei in folgendem Video dargestellten Gläser befindet sich warmes bzw. kaltes Wasser. Begründe deine Antwort.
Im Glas links breitet sich der gelbe Farbstoff schneller aus, d. h., er diffundiert schneller. Die Farbstoffteilchen dort scheinen also häufiger von Wasserteilchen angestossen zu werden, was auf höhere Geschwindigkeit der Wasserteilchen und damit auf höhere Temperatur des Wassers in diesem Glas schliessen lässt.
Weshalb erwärmt sich eine Teetasse durch den heissen Tee darin? Erkläre mit dem Teilchenmodell.
Wie wir wissen, haben Teilchen eine Eigenbewegung. Und je höher die Temperatur, desto grösser die Geschwindigkeit der Teilchen. Was passiert also mit den Teilchen der Tasse, wenn Wasserteilchen auf sie treffen?
Die Antwort erfährst du im folgenden Video:
Quelle: YouTube (Video, 49 sec).
Die Wasserteilchen im heissen Tee bewegen sich mit hoher Geschwindigkeit und stossen dauernd auf die nur langsam an Ort schwingenden Porzellanteilchen der Teetasse. Die Porzellanteilchen beginnen dadurch stärker zu schwingen (die Tasse wird wärmer), während die Wasserteilchen langsamer werden (der Tee kühlt leicht ab).
Brownsche Bewegung bei Milch
Beschreibe und erkläre die Beobachtung, die man bei einer Milchprobe unter dem Mikroskop machen kann (vgl. folgendes Video), mit dem Teilchenmodell.
Hinweis: Milch besteht im Wesentlichen aus Wasser, welches gelöste Stoffe, aber auch feinst verteilte Fetttröpfchen (Öltröpfchen) enthält. Die Fetttröpfchen sind unter dem Mikroskop sichtbar.
- Was ist unter dem Mikroskop zu sehen? 1 Satz.
- Erstelle – unter Verwendung des Teilchenmodells – eine beschriftete Skizze, welche als Erklärung für die Beobachtung dienen soll.
- Stelle dabei auch die Öltröpfchen im Teilchenmodell dar.
Quelle: Wikipedia.
Unter dem Mikroskop ist eine Zitterbewegung der Fetttröpfchen zu erkennen (= Brownsche Bewegung). Diese (grossen) Fetttröpfchen im Wasser befinden sich in permanenter, zitternder, jedoch langsamer Bewegung, da sie von den Stössen der nicht sichtbaren (viel kleineren) Wasserteilchen andauernd Richtungsänderungen erfahren. Verantwortlich für diese Stösse ist die schnelle Eigenbewegung (Wärmebewegung) der Wasserteilchen:
Brownsche Bewegung bei Milch: Ein Fetttröpfchen erfährt pro Sekunde ca. 1021 (1 Trilliarde!) Stösse von Wasserteilchen, wodurch das Tröpfchen selbst eine ungerichtete Bewegung ausführt. In der Abbildung sind der Übersichtlichkeit halber nur wenige Wasserteilchen gezeichnet.
Beschleunigung des Lösevorgangs von Zucker in Wasser
Wie kannst du den Lösevorgang von Zucker in Wasser beschleunigen? Begründe deine Antworten mit dem Teilchenmodell.
- Mindestens eine Möglichkeit müsstest du gefunden haben, nämlich das "Erwärmen" des Wassers.
- Die zweite Möglichkeit wendet man im Alltag eigentlich immer an, wenn man ein Getränk süsst.
- Die dritte Möglichkeit besteht darin, Puderzucker statt Kristallzucker zu verwenden. Wie unterscheiden sich 4 g Kristallzucker (Masse eines Würfelzuckers) von 4 g Puderzucker? Gedanklich trennen wir ein Stück Zucker in vier Bruchstücke auf:
- Erwärmen des Wassers: Die Wasserteilchen bewegen sich schneller, wodurch sie heftiger und häufiger auf die Zuckerteilchen im Gitter prallen und diese in der Folge schneller aus dem Gitter herauslösen (begünstigt wird Letzteres auch, da die Zuckerteilchen im Gitter stärker schwingen).
- Rühren: Die bereits aus dem Gitter gelösten Zuckerteilchen bzw. die Komplexe aus Zuckerteilchen und umgebenden Wasserteilchen (vgl. Theorieteil) werden durch das Rühren wegtransportiert, wodurch andere Wasserteilchen an den Zuckerkristall gelangen können und dort mit den Zuckerteilchen wechselwirken, d. h. diese über Anziehungskräfte herauslösen können.
- Pulverisieren des Zuckers: Durch die Oberflächenvergrösserung (vgl. folgende Abbildung) können gleichzeitig mehr Wassermoleküle mit Zuckerteilchen im Gitter wechselwirken und diese herauslösen. Deshalb löst sich Puderzucker schneller als Kristallzucker bzw. Kandiszucker. Die folgende Skizze dient bloss der Veranschaulichung und muss nicht im Heft festgehalten werden.
Das Pulverisieren von Kristallzucker führt zu einer Oberflächenvergrösserung und damit zu mehr Wechselwirkungsoberfläche für Wasserteilchen.