CP 5 Schmelz- und Siedepunkt
Siede- und Schmelztemperatur
Die Chemie beschäftigt sich mit Stoffen und deren Eigenschaften sowie mit Stoffänderungen. Neben Stoffeigenschaften wie der Farbe, Wärmeleitfähigkeit, Dichte usw. ist die Schmelz- und Siedetemperatur von grosser Bedeutung. Durch das Bestimmen der Schmelztemperatur eines Stoffes können beispielsweise Rückschlüsse auf dessen Reinheit gezogen werden. Der Schmelz- bzw. Siedepunkt ist charakteristisch für einen reinen Stoff und liegt bei gegebenem Druck immer bei derselben Temperatur.
Um einen Stoff zu schmelzen oder zu verdampfen, kann als Wärmequelle ein Bunsenbrenner eingesetzt werden.
Der Bunsenbrenner
Der Bunsenbrenner ist ein Gerät, welches du in fast jedem Labor findest. Mit dem Bunsenbrenner können beispielsweise Flüssigkeiten sehr einfach und schnell erwärmt werden. Wird der Brenner jedoch falsch bedient, kann es schnell gefährlich werden. Neben Sicherheitaspekten lernst du Im Folgenden die Bestandteile, die Funktionsweise sowie die korrekte Bedienung des Bunsenbrenners kennen. Zudem erfährst du, wo die heisseste Zone der Bunsenbrennerflamme ist.
Den Bunsenbrenner lernst du nun 1:1 kennen. Gehe dazu ins Labor und nimm deinen Laptop und passende Kopfhörer mit.
Aufgabe:
Nimm den Bunsenbrenner aus der Schublade auf der Fensterseite deines Arbeitsplatzes (es hat für jede Person einen) und Zündhölzer aus der anderen Schublade. Falls du lange Haare hast, sind diese mit einem "Haargummi" zusammenzubinden – letztere liegen zentral bereit. Gehe nun die untenstehenden Schritte praktisch durch.
Bestandteile und Bedienung des Bunsenbrenners
1. Bestandteile
Gaszufuhr G
zu: Regler G waagrecht
offen: Regler G senkrecht
Luftzufuhr L
zu: Regler L unten (Loch nicht sichtbar)
offen: Regler L oben (Loch sichtbar)
2. Anschluss ans Gasnetz
Das offene Ende des Gasschlauchs wird über die Düse des gelben Gashahns (G) gestülpt. Der Schlauch soll satt sitzen, wenn du ihn aber zu stark andrückst, kannst du ihn fast nicht mehr entfernen.
3. Öffnen der Gasleitung
Die Regler des Brenners müssen beide in geschlossener Position sein. Nun kannst du den gelben Gashahn (G) runter drücken und mit einer Vierteldrehung (im Gegenuhrzeigersinn) voll öffnen.
4. Anzünden des Gases
Öffne den Regler für die Gaszufuhr mit einer Drehung um ca. 45°. Halte nun ein Streichholz über den Brenner bis dieser brennt.
Es kann sein, dass dies etwas dauert, da bei der ersten Benutzung noch Luft im Schlauch und Brenner ist.
5. Betrieb
Wenn das Gas brennt, kannst du die Gaszufuhr aufdrehen (es entsteht die leuchtende Flamme). Durch Hochschieben des Reglers für die Luftzufuhr (Loch sichtbar) entsteht die rauschende Flamme. In der Regel wird damit gearbeitet.
6. Sparflamme
Wenn du den Brenner für kurze Zeit nicht brauchst, kannst du beide Regler schliessen. Dabei entsteht die Sparflamme. Wenn du den Brenner wieder brauchst, kannst du die Regler einfach wieder langsam aufdrehen.
7. Ausser Betrieb nehmen
Um den Brenner ausser Betrieb zu nehmen, drehst du beide Regler zu und schliesst den gelben Gashahn (Drehung im Uhrzeigersinn).
Der Bunsenbrenner wird nicht ausgepustet.
Wo ist die Brennerflamme am heissesten?
Quelle: YouTube (Video, 2:16 min).
Wie funktioniert der Bunsenbrenner?
Quelle: YouTube (Video, 32 sec, ohne Ton).
Warum man beim Erhitzen von Flüssigkeiten vorsichtig sein muss!
Quelle: YouTube (Video, 1:05 min, ohne Ton).
Nimm nun die CP-Anleitung zur Hand, studiere die Einleitung und starte anschliessend mit dem Versuch 1.
Bearbeite die Aufgaben 1–3.
Die Aufgaben 4 und 5 sind freiwillig zu bearbeiten.
Erstelle mit den protokollierten Werten zu den Versuchen 1 und 2 je ein Diagramm (x-Achse: Zeit; y-Achse: Temperatur).
Vgl. deine eigenen Grafiken.
Suche im Internet nach der Schmelztemperatur von Stearinsäure und der Siedetemperatur von Ethanol.
Überprüfe anschliessend, ob die gefundenen Werte mit einer Auffälligkeit im Graphen deines Diagramms übereinstimmen. Notiere deine Beobachtung und eine mögliche kurze Erklärung für die Auffälligkeit.
- Es geht um die waagrechten oder fast waagrechten Abschnitte im Graphen.
- Bei welcher Temperatur befinden sich diese? Falls du bei einem Graphen gar kein Abflachen siehst: Bei welcher Temperatur müsste dieses Abflachen zu sehen sein?
- Und wie sind diese Abschnitte, bei welchen die Temperatur nicht zunimmt, zu erklären?
- Eine gute Anlaufstelle für Siede- und Schmelzpunkte von Stoffen ist Wikipedia.
Schmelztemperatur von Stearinsäure (Wikipedia); Siedetemperatur von Ethanol (Wikipedia).
Bei diesen Temperaturen sollten deine Graphen jeweils eine "kleine Delle" aufweisen beziehungsweise "abflachen". Das bedeutet, dass z. B. während des Schmelzprozesses die Temperatur nicht weiter ansteigt. Die zugeführte Energie wird für den Phasenübergang von (s) → (l) benötigt. Analoge Aussage gilt für den Übergang (l) → (g).
Vergleiche deine Resultate mit denen einer anderen Gruppe.
Die Graphen sollten qualitativ (also den grundsätzlichen Verlauf betreffend) gleich aussehen. Die konkreten gemessenen Temperaturen können jedoch – durch die beschränkte Genauigkeit der Thermometer und durch Ablesefehler – leicht unterschiedlich sein.
Diskutiert gemeinsam, wie die beobachteten Resultate mit dem Teilchenmodell erklärt werden können.
Rufe dir Folgendes in Erinnerung:
- Was passiert mit den Teilchen bei Erhöhung der Temperatur?
- Wann bzw. wo müssen Anziehungskräfte zwischen den Teilchen überwunden werden?
Beim Wechsel des Aggregatzustands von flüssig zu gasförmig werden die einzelnen Teilchen weiter voneinander entfernt. Dazu müssen die Anziehungskräfte zwischen den Teilchen überwunden werden. Dies benötigt Energie, welche während des Aggregatzustandswechsels nicht zur Erwärmung des Stoffes (Beschleunigen der Teilchen) führt. Die Temperatur des Stoffs bleibt also so lange konstant, bis der Wechsel des Aggregatzustands vollzogen ist. Analog gilt dies auch für den Übergang von fest nach flüssig. In der Regel braucht es hier aber weniger Energie, weil die Teilchen nicht so weit voneinander entfernt werden.
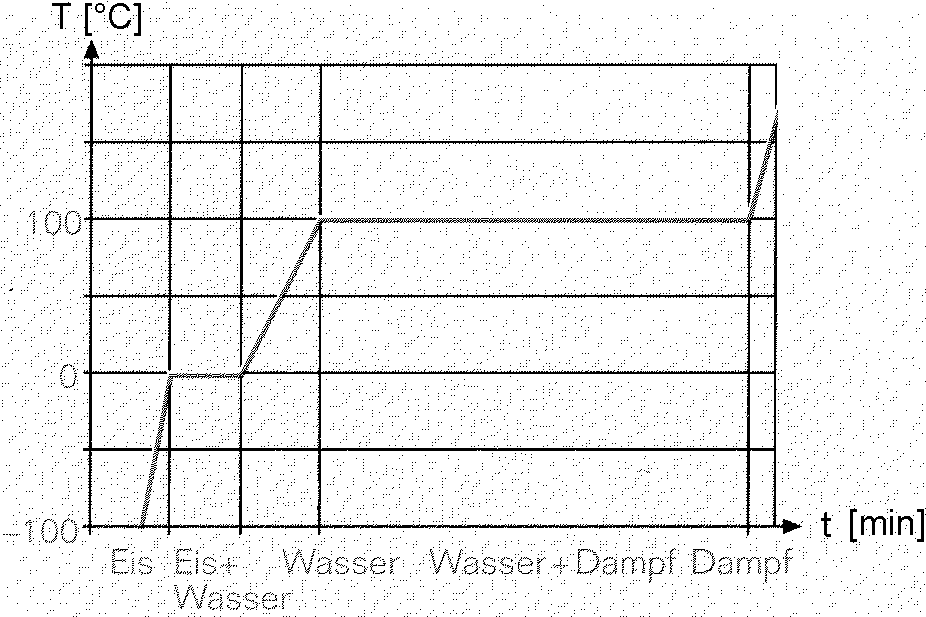
Erstelle ein Temperatur-Zeit-Diagramm für Wasser, welches als Feststoff (Eis) kontinuierlich erwärmt wird, bis es gasförmig (Wasserdampf) ist.
Vorgaben: Das Eis hätte ein Starttemperatur von –100 °C und würde zu 200 °C heissem Wasserdampf überführt werden; x-Achse: Zeit; y-Achse: Temperatur.
- Hier gilt es die Erkenntnisse der zwei Versuche zu kombinieren, wobei Wasser einen Schmelzpunkt von 0 °C und einen Siedepunkt von 100 °C aufweist.
- Überlege dir, welche Abschnitte waagrecht verlaufen müssen, da alle zugeführte Wärme für die Überwindung der Anziehungskräfte zwischen den Teilchen benötigt wird (aus Versuch 1 und 2 bekannt).
- Welche Abschnitte müssen linear ansteigend verlaufen, da alle zugeführte Wärme zu schnellerer Teilchenbewegung führt?
Der Aggregatzustand eines Stoffs ist nicht nur temperaturabhängig, sondern auch druckabhängig. In grösserer Höhe herrscht ein geringerer Luftdruck als in tieferen Luftschichten. Das heisst, dass in der Höhe die Luft dünner bzw. weniger dicht ist, was wiederum bedeutet, dass pro Volumeneinheit weniger Luftteilchen als auf Meereshöhe vorliegen.
Man erhitzt Wasser auf Meereshöhe respektive auf dem Matterhorn: Wo wird das Wasser zuerst sieden?
Weniger Luftteilchen pro Volumeneinheit bedeutet auch weniger Luftteilchen pro Flächeneinheit. Damit prallen auch weniger Luftteilchen auf eine Flüssigkeitsoberfläche.
Das Wasser siedet auf dem Matterhorn schneller (bzw. schon bei 85 °C), da in grösserer Höhe aufgrund der dünneren Luft weniger Luftteilchen pro Zeiteinheit auf die Wasseroberfläche prallen und dort die Wasserteilchen beim Loslösen von der Oberfläche hindern.
(In der Praxis ist jedoch dieses schnellere Sieden für Alpinisten ein Nachteil, da z. B. Teigwaren aufgrund der geringeren Temperatur des Kochwassers weniger schnell al dente werden.)
Bei welcher konkreten Temperatur sollte Wasser im Kantilabor in Willisau (rund 600 m. ü. M.) sieden?
Die Antwort lässt sich aus diesem Diagramm herauslesen.
Ein Skalenstrich auf der x-Achse entspricht 600 Höhenmetern, was direkt der Höhe des Schlossberghügels von Willisau entspricht. Damit ergibt sich der Schnittpunkt mit dem abgebildeten Temperatur-Höhe-Graphen (Geraden) bei einer Temperatur von 98 °C.
Warum ist Butan (Siedepunkt: –0.5 °C) in einer Campinggaskartusche bei Zimmertemperatur flüssig, kommt jedoch beim Öffnen des Gashahns gasförmig heraus?

In folgendem Video siehst du das Prinzip, wie ein Gas verflüssigt werden kann.
Quelle: YouTube (Video, 1:43 min).
Das Butangas wurde beim Abfüllen durch Druck verflüssigt. Durch den aufgebauten Druck kommt es zur Reduktion des Gasvolumens (Video, 10 sec, ohne Ton), wodurch sich die Gasteilchen bei genügend Druck so nahe kommen, dass Anziehungskräfte zwischen den Teilchen wirksam werden, wodurch Butan flüssig wird.
Beim Öffnen des Gashahns kommt es schlagartig zur Druckabnahme, wodurch die Teilchen wieder grössere Abstände einnehmen und Butan gasförmig wird.