CP 6&7 Gemischtrennung
(In diesem CP beginnst du ausnahmsweise direkt mit dem Lesen der CP-Anleitung bzw. mit dem Versuch. Während Wartephasen im Rahmen des Versuchs – oder spätestens als Hausaufgabe – soll die untenstehende Theorie studiert bzw. die Aufgaben 1–4 bearbeitet werden.)
Warum sind reine Stoffe wichtig?
Im ersten Kapitel hast du gelernt, was man in der Chemie unter einem Stoff versteht. Wenn in einem Labor beispielsweise ein Wirkstoff für ein Medikament hergestellt werden soll, ist es wichtig, dass die verwendeten Ausgangsstoffe möglichst rein sind und nicht noch weitere andere Stoffe enthalten, welche die Herstellung des Wirkstoffs beeinträchtigen oder sogar schädlich sein könnten. In der Natur kommen Stoffe allerdings so gut wie nie in reiner Form (Reinstoff) vor, sondern meistens als Gemisch.
Im Folgenden lernst du zuerst, was ein Reinstoff bzw. ein Gemisch ist und welche Gemischtypen es gibt. Im Anschluss erfährst du, wie man Gemische mit sogenannten Trennmethoden in einzelne Reinstoffe auftrennen kann.
Was ist ein Reinstoff?
Ein reiner Stoff besitzt spezifische und konstante physikalische Eigenschaften, insbesondere einen scharf begrenzten Schmelz- und Siedepunkt (Smt.: Schmelztemperatur; Sdt.: Siedetemperatur). Klick auf die folgenden Abbildungen für ein grösseres Bild.
Beispiele:
Ein Bergkristall (vgl. Abbildung oben) sieht einheitlich aus. Er besteht nur aus dem Stoff Siliciumdioxid (= Quarz), d. h., er verfügt über eine konstante Zusammensetzung. Quarz lässt sich mit physikalischen Methoden nicht weiter auftrennen. Der Bergkristall ist damit ein reiner Stoff. Reinstoffe sehen aufgrund ihrer konstanten Zusammensetzung einheitlich (homogen) aus; umgekehrt sind jedoch nicht alle einheitlich aussehenden Stoffe Reinstoffe (z. B. Glas, Salzwasser).
Was ist ein Gemisch?
Beispiel:
Beim Gestein Granit sind von blossem Auge unterschiedliche farbige Bereiche sichtbar. Es handlelt sich dabei um die drei Mineralien Quarz (grau), Feldspat (gelbweiss) und Glimmer (schwarz). Durch Zerschlagen und Zerkleinern eines Granitbrockens mit einem Hammer kann man die drei Komponenten (Reinstoffe) erhalten. Granit ist somit ein Gemisch.

Granit (klick auf das Bild um die 3 Komponenten besser zu sehen)
Aufgabe 1:
Übertrage die folgende Tabelle (ohne Bild) in dein Journal und ergänze die Lücken. Klicke auf das Miniaturenbild, um das Gemisch betrachten und nähere Informationen erhalten zu können.
Tabelle: Beispiele von Gemischtypen
| Beispiel | Bild | Gemischtyp | homogen / heterogen | Anzahl Phasen und Phasenart |
|---|---|---|---|---|
Salzwasser |
 |
Echte Lösung | homogen | 1 flüssige |
Messing |
 |
Legierung | ||
schlammiges Wasser |
 |
Suspension | 1 flüssige, 1 feste | |
Milch |
 |
Emulsion | ||
Nebel, Wolken |
 |
Nebel | ||
Holzkohlenrauch |
 |
Rauch | ||
Badeschaum |
 |
Flüssigschaum | ||
Granit |
 |
Gemenge |
Kontrolliere deine Lösung zur Aufgabe 1 und fahre anschliessend mit dem Studium des nächstens Kapitels weiter.
Gemischtrennung
Die meisten Stoffe, mit denen wir im Alltag konfrontiert werden, sind Gemische. Um reine Stoffe zu erhalten, sind meistens aufwendige physikalische Reinigungs- und Trennverfahren notwendig.
Aufgabe 2:
Setze die Kopfhörer auf und schau dieses Video (6:20 min, nanoo.tv) zu einfachen Methoden der Gemischtrennung.
Einige wichtige Trennmethoden
| Methode | Trennungsprinzip | Beispiele |
|---|---|---|
Sedimentation Zentrifugation (beschleunigte Sedimentation) |
Unterschiedliche Dichte Die Trennung erfolgt entweder durch die Schwerkraft (→ Sedimentation) respektive durch Fliehkräfte (→ Zentrifugation). |
|
Filtration Sieben |
Unterschiedliche Partikelgrösse Die Poren in einem Filter bzw. die Löcher in einem Sieb lassen nur Partikel einer bestimmten Grösse (kleiner als die Pore bzw. das Loch) passieren. |
|
Extraktion (vgl. Versuch) |
Unterschiedliche Löslichkeit Stoffe werden mit einem geeigneten Lösungsmittel aus dem Gemisch herausgelöst (extrahere [lat.]: herausziehen). |
|
Chromatographie (vgl. Versuch) |
Unterschiedliche Adsorption (Haftung) Stoffe werden durch ein Fliessmittel über eine feste Phase transportiert: Der Stoff mit der geringsten Adsorption (Haftungsfähigkeit) wird vom Fliessmittel am weitesten transportiert. |
|
Umkristallisation |
Unterschiedliche Löslichkeit Lässt man eine heisse gesättigte Lösung abkühlen, so kristallisiert der im Überschuss vorhandene Stoff zuerst aus. Die in viel geringeren Mengen vorhandenen Verunreinigungen bleiben in Lösung. |
|
Lyophilisation (Gefriertrocknung) |
Bei wärmeempfindlichen Stoffen kann zur Entfernung des Extraktionsmittels (z. B. Wasser) durch Abkühlung das Wasser in Form von Eis abgetrennt werden |
|
Destillation (vgl. Versuch) |
Unterschiedlicher Siedepunkt Beim Erhitzen einer Lösung oder einer Emulsion verdampft der Stoff mit dem tieferen Siedepunkt zuerst und kann mittels Kühlung wieder verflüssigt werden. |
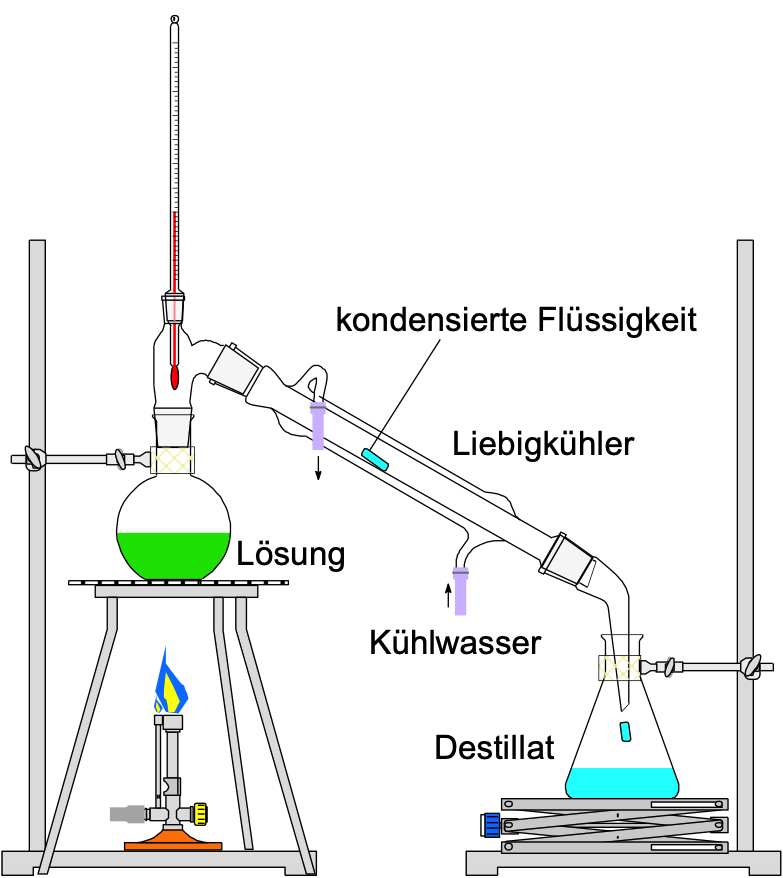
|
Die Aufgaben 1–4 beziehen sich direkt auf die Theorie und sollten während des CP 6 beantwortet werden.
Die Aufgaben 5–7 beziehen sich auf den Versuch und werden als Hausaufgabe im Rahmen der Vorbereitung des Vortrags beantwortet.
Die Aufgaben 8–9 werden erst nach dem Vortrag in Angriff genommen (CP 7).
(Diese Aufgabe solltest du bereits bearbeitet haben. Hier geht's zur Lösung.)
Übertrage die Tabelle im Theorieteil – ohne Bild – in dein Journal und ergänze die Lücken.
Beim Klick auf ein Miniaturenbild erhält man Erklärungen zum Gemisch.
Tabelle: Beispiele von Gemischtypen
| Beispiel | Bild | Gemischtyp | homogen / heterogen | Anzahl Phasen und Phasenart |
|---|---|---|---|---|
Salzwasser |
 |
Echte Lösung | homogen | 1 flüssige |
Messing |
 |
Legierung | homogen | 1 feste |
schlammiges Wasser |
 |
Suspension | heterogen | 1 flüssige, mehrere feste |
Milch |
 |
Emulsion | heterogen | 2 flüssige |
Nebel, Wolken |
 |
Nebel | heterogen | 1 flüssige, 1 gasförmige |
Holzkohlenrauch |
 |
Rauch | heterogen | 1 feste, 1 gasförmige |
Badeschaum |
 |
Flüssigschaum | heterogen | 1 flüssige, 1 gasförmige |
Granit |
 |
Gemenge | heterogen | mehrere feste Phasen (hier 3) |
(Gehe nun zurück zur Theorie.)
(Hier musst du keine Notizen machen.)
Setze die Kopfhörer auf und schau dieses Video (6:20 min, nanoo.tv) zu einfachen Methoden der Gemischtrennung.
(Gehe nun zurück zur Theorie.)
Erstelle ein Mindmap mit den Begriffen, die im Theorieteil jeweils in einem Kasten erklärt wurden.
Wie du in der Theorie gelesen hast, ist Bergkristall ein Stoff, der in der Natur als Reinstoff vorkommt.
Welche Stoffe, die in der Natur oder im Alltag 'praktisch rein' vorkommen, kennst du noch?
Die Aufgaben 5–7 sind je nach durchgeführtem Versuch unterschiedlich und finden sich in der Anleitung.
Die Antworten zu den Aufgaben sollten im Rahmen des Vortrags beziehungsweise dessen Besprechung beantwortet worden sein.
Scheibenwischflüssigkeit fürs Auto besteht im Wesentlichen aus einem Alkohol und Wasser.
- Welcher Gemischtyp liegt vor?
- Mit welchem Trennverfahren kann man den Alkohol vom Wasser trennen? Begründe.
Hilfeleistung findet sich im Kapitel "Einige wichtige Trennmethoden".
Eine Lösung, welche aus zwei (oder mehr) Flüssigkeiten besteht, lässt sich durch Destillation trennen. Die unterschiedlichen Reinstoffe, aus welchen die Lösung besteht, besitzen jeweils einen spezifischen Siedepunkt. Durch Erwärmen des Gemischs siedet der Stoff mit dem tieferen Siedepunkt zuerst (hier der Alkohol) und entweicht aus dem Gemisch.
(Hier musst du keine Notizen machen.)
Setze die Kopfhörer auf und schau dieses Video (7:40 min, nanoo.tv) zu anspruchsvollen Methoden der Gemischtrennung.


