CP 8 Chemische Reaktion und Energie
Was ist eine chemische Reaktion?
Beim Brechen eines Holzstäbchens (Grillspiesschen) ändert sich bloss die Form: Aus einem Stück entstehen zwei Stücke. Das Holz sieht jedoch immer noch gleich aus und fühlt sich gleich an. Ein solcher Vorgang, bei welchem sich die stofflichen Eigenschaften bzw. die stoffliche Zusammensetzung nicht ändern, ist ein physikalischer Vorgang.
Wird das Holzstäbchen jedoch kurz einer Flamme ausgesetzt, beginnt es zu brennen. Das Holz wird schwarz, fühlt sich anders an, es riecht anders, es entsteht Rauch und es wird Wärme abgegeben. Ein solcher Vorgang, welcher mit der Änderung der stofflichen Zusammensetzung und damit der stofflichen Eigenschaften verbunden ist, heisst chemische Reaktion.
Merkmale von chemischen Reaktionen (aus dem Alltag)
- Stehen gelassene Milch wird sauer und beginnt zu stinken (Geschmacks- und Geruchsänderung).
- Ein Stück Papier verbrennt (Flammenbildung, Wärmeabgabe, Rauchbildung).
- Eine Brausetablette löst sich in Wasser unter Sprudeln auf (Gasbildung).
- Zucker wird beim Erhitzen zuerst gelborange (Caramel), dann schwarz und beginnt aufzuschäumen (Farbveränderung, Geschmacks- und Geruchsänderung, Rauchbildung, Gasbildung).
Nicht immer ist die Bildung neuer Stoffe, auf welche neue Eigenschaften zurückzuführen sind, so gut zu beobachten. In diesem Zusammenhang schauen wir zwei weitere chemische Reaktionen an: Löse die Aufgaben 1–2.
Chemische Reaktion und Energie
Wie wir beim Silberoxid- und beim Eisen-Schwefel-Versuch gesehen haben, ist eine chemische Reaktion nicht nur durch die Bildung neuer Stoffe mit neuen Eigenschaften charakterisiert, sondern auch durch einen Energieumsatz (in unserem Beispiel Wärmeabgabe bzw. Wärmeaufnahme):
Chemische Reaktionen sind Stoffumwandlungen (Bildung neuer Stoffe mit neuen Eigenschaften). Sie sind mit Energieaufnahme oder Energieabgabe verbunden. Das heisst, eine chemische Reaktion ist immer von einem Energieumsatz begleitet.
Dass 'Energie' in Stoffen steckt, wird bei gewissen Reaktionen durch Lichterscheinungen (Lichtenergie), Wärmeentwicklung (Wärmeenergie) und Stromfluss (elektrische Energie, z. B. bei Batterien) offensichtlich. Einige Stoffe enthalten mehr Energie als andere (vgl. Energiegehalt bei Lebensmitteln). Das heisst, der Energiegehalt von Stoffen ist verschieden. Wärmeenergie ist in der Praxis bei Beobachtung von chemischen Reaktionen die dominante Energieform.
Bei einer chemischen Reaktion wird Energie netto (d. h. in der Gesamtbilanz) abgegeben oder aufgenommen. Das heisst, der entstehende neue Stoff ist entweder energieärmer oder eben energiereicher. Diese Änderung der Energie in Abhängigkeit des Reaktionsverlaufs (Zeit) kann in einem Energiediagramm dargestellt werden:
Energiediagramm für eine exotherme Reaktion
Wird bei einer chem. Reaktion netto Energie abgegeben, so liegt eine exotherme Reaktion vor. Die Reaktionsprodukte sind folglich energieärmer als die Ausgangsstoffe.
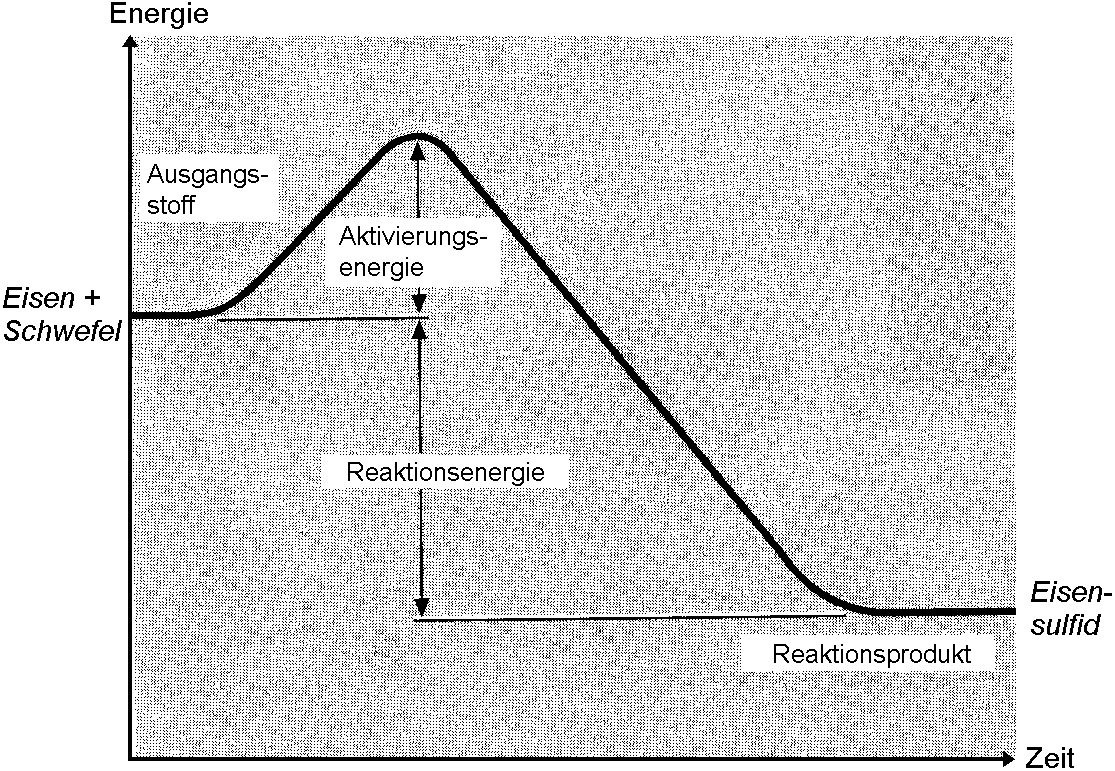
Energiediagramm für die Reaktion von Eisen mit Schwefel: Nach Überwindung der Aktivierungsenergie (Bunsenbrenner) muss nicht mehr weiter erhitzt werden, da die Reaktion selbst die notwendige Energie für die Reaktion der noch nicht reagierten Stoffanteile liefert. Das Aufglühen zeigt, dass netto Wärme abgegeben wird und somit eine exotherme Reaktion vorliegt [thermos (gr.): Wärme; exo (gr.): heraus; wörtlich: Wärme kommt (aus den Stoffen) heraus].
Energiediagramm für eine endotherme Reaktion
Bei einer endothermen Reaktion wird netto Energie zugeführt respektive aus der Umgebung aufgenommen. Die Reaktionsprodukte sind folglich energiereicher als die Ausgangsstoffe.
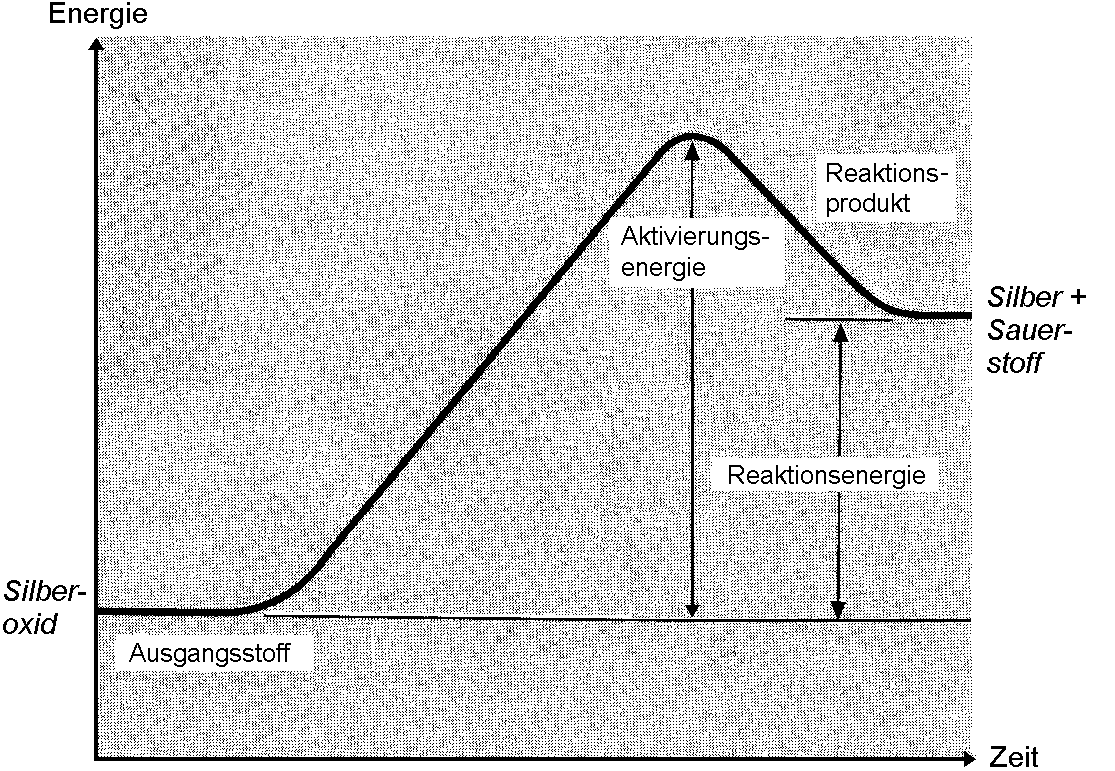
Energiediagramm für die Reaktion von Silberoxid: Es muss stetig (Aktivierungs-)Energie mit dem Bunsenbrenner zugeführt werden, damit alle Stoffanteile reagieren. Ein Teil der Energie ist danach in den neuen Stoffen selbst [thermos (gr.): Wärme; endo (gr.): hinein; wörtlich: Wärme geht (in die Stoffe) hinein]. Ein kleiner Teil der Energie wird als Wärme abgegeben (zu gering, um ein Aufglühen beobachten zu können).
Die Aktivierungsenergie ist jene Energie, die bei einer Reaktion zu Beginn zugeführt werden muss, damit die Reaktion überhaupt erst startet.
Bsp.: Zur Verbrennung von Laborgas genügt ein brennendes Streichholz als Aktivierungsenergie. Ein Eisen-Schwefel-Gemisch muss jedoch stark erhitzt werden, bis die Reaktion startet. Durch die Zuführung von Wärme (Aktivierungsenergie) werden zum Beispiel die starken Anziehungskräfte zwischen den Teilchen in einem Feststoff überwunden. Die Stoffe gelangen somit in einen reaktionsbereiten Zustand.
Die Reaktionsenergie entspricht der Differenz des Energiegehalts der Ausgangsstoffe zum Energiegehalt der Reaktionsprodukte. Es ist dies also jene Energiemenge, die netto frei oder aufgenommen wird bei einer chemischen Reaktion.
Mit der Reaktionsenergie ist häufig die sogenannte Reaktionsenthalpie gemeint [Abk.: ΔH; Heat (engl.): Wärme]. Das ist die Wärmemenge, die bei konstantem Druck aufgenommen oder abgegeben wird. Die Einheit ist, wie üblich bei Energie, das Joule (J). Bei einer endothermen Reaktion hat ΔH ein positives Vorzeichen. Bei exothermen Reaktionen ergibt sich ein negatives Vorzeichen für ΔH. Die Angabe ΔH = –890 kJ für die Verbrennung von 16 g Erdgas bedeutet also, dass bei dieser Reaktion Wärmeenergie in der Höhe von 890 kJ (Kilojoule) frei wird (oder 'weggeht', deshalb das Minus).
Gehe nun zur Aufgabe 3.
Die Aufgaben 1–2 werden vor dem Versuch bearbeitet.
Sämtliche fünf Aufgaben müssen bearbeitet werden (Aufgabe 5 wohl als Hausaufgabe).
Halte die Beobachtungen, die in folgendem Video bei der Reaktion von Eisen mit Schwefel zu machen sind, in deinem Journal auf der Basis der folgenden Tabelle fest:
Versuch: Eisen und Schwefel wird gemischt und das Gemisch erhitzt.
- Vergleiche die Eigenschaften des "Eisen-Schwefel-Gemischs" vor und nach dem Erhitzen, d. h., ergänze die Tabelle.
- Was ist während der Reaktion zu sehen?
- Muss permanent erhitzt werden?
Quelle: YouTube (Video, 2:25 min).
Eine Eigenschaft des Produkts sieht man nur in folgendem Video:
Quelle: YouTube (Video, 16 sec).
Nach kurzem Erhitzen glüht das Gemisch auf und glüht dann – auch ohne weiteres Erhitzen – von alleine durch, wobei z. T. Funken, Flammen sichtbar sind, d. h. viel Wärme frei wird. Es ist ein Stoff mit offenbar völlig neuen Eigenschaften entstanden. Dieser Stoff heisst Eisensulfid.
Halte die Beobachtungen fest, die in folgendem Video beim Erhitzen von Silberoxid zu machen sind:
- Was passiert mit dem Pulver?
- Vergleiche das Erhitzen und die Wärmeabgabe bei diesem Versuch mit dem Eisen-Schwefel-Versuch.
- Was kannst du aus (2) folgern?
- Recherchiere in der Wikipedia, was eine positive Glimmspanprobe konkret nachweist.
- Wenn du Beobachtungen aus diesem und dem Eisen-Schwefel-Versuch zusammen betrachtest: Welche Merkmale sind für chemische Reaktionen offenbar typisch?
Quelle: YouTube (Video, 2:20 min).
Aus dem schwarzen Pulver (= Silberoxid) entsteht ein weiss-silbrig glänzendes Pulver (= Silbermetall), wobei ein Gas entsteht, welches einen Glimmspan zum Brennen bringt (= Sauerstoff). Da permanentes Erhitzen nötig und kein Aufglühen ersichtlich war, müssen die entstandenen zwei Stoffe energiereicher sein als der Ausgangsstoff.
Merkmale chemischer Reaktionen sind u.a.: Farbveränderung, Dichteveränderung, Gasbildung und Energieumsatz (Wärmeaufnahme beim Silberoxid-Versuch, Wärmeabgabe bzw. Flammen-/ Funkenbildung beim Eisen-Schwefel-Versuch).
(Nimm nun die CP-Anleitung zur Hand, studiere die Einleitung und starte anschliessend mit dem Versuch "Kupfermetallgewinnung aus Kupferoxid".)
(Studiere zuerst die Theorie zum Energiediagramm und kehre dann hierher zurück.)
Wie geht man beim Zeichnen eines Energiediagramms vor?
(Hier musst du keine Notizen machen.)
Das folgende Video zeigt am Beispiel der Reaktion von Eisen mit Schwefel, wie man Schritt um Schritt zum fertigen Energiediagramm kommt.
Hinweis: Hier muss das Produkt energieärmer (weiter unten im Energiediagramm) sein, da nur zu Beginn erhitzt werden musste und danach ein langes Aufglühen (Wärmeabgabe) ersichtlich war.
Quelle: YouTube (Video, 2:23 min).
Und im Folgenden noch ein analoges Video zur Erstellung des Energiediagramms für die Reaktion von Silberoxid:
Hinweis: Hier müssen die Produkte energiereicher (weiter oben im Energiediagramm) sein, da permanent erhitzt werden musste und kein Aufglühen (Wärmeabgabe) ersichtlich war.
Quelle: YouTube (Video, 1:24 min).
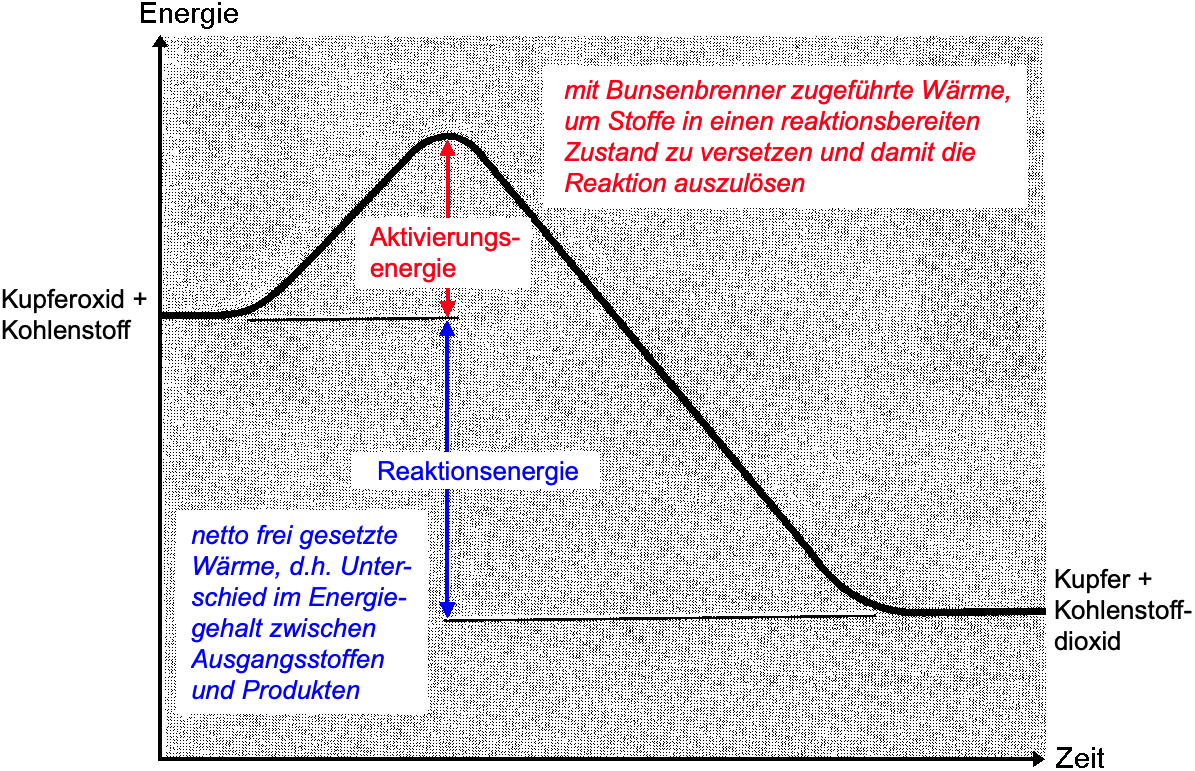
Erstelle ein Energiediagramm für den Versuch "Kupfermetallgewinnung aus Kupferoxid".
- Liegt eine exotherme oder eine endotherme Reaktion vor? Begründe.
- Welche Funktion hatte der Bunsenbrenner? Hätte man ihn nach Start der Reaktion auch wegziehen können?
- Zeichne die zwei relevanten Energiegrössen ein und erläutere diese direkt in oder unter deinem Diagramm.
- Vergiss nicht die Namen der Ausgangsstoffe und Produkte zuzuordnen und die Achsen anzuschreiben.
- Halte zusätzlich – unter dem Energiediagramm – die Reaktionsgleichung für diese Reaktion fest (von der Anleitung, S. 1 zu übertragen).
Es liegt eine exotherme Reaktion vor, da in Form eines Aufglühens des Gemischs eine Wärmeabgabe ersichtlich war.
Den Bunsenbrenner brauchte man nur, um die Reaktion zu starten. Dazu brauchte es jedoch hier viel Zeit, d. h., es musste relativ viel Aktivierungsenergie zugeführt werden. Nachher liefert die Reaktion knapp genügend Wärme, um noch nicht reagierte Stoffanteile in einen aktivierten Zustand überzuführen.
Ordne in deinem Journal zu den Versuchsbeobachtungen beim Schritt 5 die folgenden Interpretationen zu:
- schwarz = nicht reagierte Stoffanteile
- glänzend rotbraun = Kupfermetall
- rot = Nebenprodukt Kupfer(I)-oxid (welches durch blosses Erhitzen – ohne Reaktion mit Kohlenstoff – aus Kupfer(II)-oxid entsteht)
(Bearbeite nun die Aufgabe 5.)
Wo liegt ein chemischer (c), wo ein physikalischer (p) Vorgang vor?
- Ein Nagel aus Eisen rostet.
- Zucker löst sich im Wasser auf.
- Aus Öl und Essig wird eine Salatsauce zubereitet.
- Kalk löst sich nach Kontakt mit einem Entkalker unter Bläschenbildung auf.
- Aus schwarz-violetten Iodkristallen entsteht beim Erhitzen violetter Dampf.
- Eine Suppe beginnt zu kochen.
- Nach Entfernen der luftdichten Verpackung wird ein Wärmebeutel (Handwärmer) langsam warm.
- Eine Scheibe Toastbrot wird im Toaster braun.
Überlege dir jeweils, ob die Eigenschaften der Stoffe bestehen bleiben (= physikalischer Vorgang) und ob neue Eigenschaften wahrnehmbar sind (= chemischer Vorgang).
(Es genügt in deinem Heft – neben den Beispielen selbst – deren Begründung in Stichworten festzuhalten).
- Rosten (c): Farbveränderung, Texturveränderung (von glatt und glänzend zu rauh und matt), von verformbar zu brüchig.
- Lösen von Zucker in Wasser (p): Die Eigenschaft "süss" ist auch im Zuckerwasser noch wahrnehmbar; wenn man Zuckerwasser erhitzt, bildet sich am Pfannendeckel Kondenswasser (das Wasser ist also auch immer noch unverändert da).
- Salatsauce aus Öl und Essig zubereiten (p): Hier entsteht ein blosses Gemisch (Emulsion), dessen Bestandteile auch von Auge noch sichtbar sind.
- Kalk schäumt auf bei Kontakt mit Entkalker (c): Gasbildung, ohne aktiv zu erhitzen, weist auf neuen Stoff hin.
- Iod erhitzen (p): Wird der Dampf wieder abgekühlt, erhält man wieder Iodkristalle (das Iod ist also immer noch da). Achtung: Die "verschiedenen" Farben sind nur unterschiedliche Farbintensitäten aufgrund höherer bzw. tieferer Iodkonzentration. Aggregatzustandsänderungen sind immer physikalischer Natur.
- Suppekochen (p): Hier verdampft bloss ein Teil des Wassers, die Suppe schmeckt heiss aber immer noch gleich wie warm/kalt.
- Aktivierter Wärmebeutel (c): Die Diffusion von Luft in den Beutel ermöglicht eine exotherme Reaktion der Stoffe (Eisen) im Beutel mit dem Luftsauerstoff (Energieumsatz bzw. Wärmeabgabe).
- Toasten (c): Das getoastete Brot hat eine andere Farbe und riecht/schmeckt auch anders.