CP 9 Synthese und Analyse
Die kleinsten Teilchen heissen Atome
In diesem Praktikum möchten wir uns klar machen, was auf Teilchenebene bei einer chemischen Reaktion (z. B. bei der Reaktion von Eisen mit Schwefel) passiert.
Nach Demokrit (4. Jh. v. Chr.) bestehen alle Stoffe aus kleinsten unteilbaren Teilchen, den Atomen [atomos (gr.): unteilbar]. Der englische Naturforscher und Chemiker Dalton nahm diese Vorstellung bzw. den Begriff "Atom" von Demokrit auf und sagte aus, dass Atome kleinste, unteilbare, kugelförmige Teilchen sind, die sich in Grösse und Masse unterscheiden. So ist zum Beispiel ein Sauerstoffatom grösser und schwerer als ein Wasserstoffatom:

John Dalton (Quelle: Wikipedia , modifiziert).
Elementarstoffe bestehen nur aus einer Atomsorte
Beim Eisen-Schwefel-Versuch aus dem letzten CP kamen die Stoffe Schwefel und Eisen zur Reaktion. Das gelbe Pulver Schwefel besteht nur aus Schwefelatomen (Abb. ganz links), das Eisenpulver nur aus Eisenatomen (Abb. ganz rechts). Beide Stoffe sind somit Elementarstoffe:
Ein Elementarstoff ist ein Reinstoff, der aus gleichen Atomen besteht. Die Atome verschiedener Elementarstoffe unterscheiden sich in ihrer Grösse und Masse.
Elementarstoffe kann man chemisch nicht weiter zerlegen (so kann man Eisen nicht weiter zerlegen, sodass kein Eisen mehr vorliegt).
Das Periodensystem der Elemente (PSE) und der Begriff 'Element'
Es gibt über 100 verschiedene Atomsorten bzw. Elementarstoffe, die oft einfach als 'Elemente' bezeichnet werden. Alle Elemente, die es im Universum gibt, sind im sogenannten Periodensystem der Elemente (PSE) aufgeführt. Bereits zu Beginn des 20. Jahrhunderts waren alle 92 natürlichen Elemente bekannt. Davon zählen 77 zu den Metallen und 15 zu den Nichtmetallen. Im PSE finden sich bei jedem Element (z. B. Schwefel) Angaben, die sich auf den Elementarstoff beziehen (das gelbe Schwefelpulver schmilzt bei 115 °C) und die sich auf die Atomsorte beziehen (ein Schwefelatom ist 32.07 u schwer). Die letztere Zahl gibt die relative Atommasse in unit (u) wieder und bedeutet, dass ein Schwefelatom rund 32-mal schwerer ist als ein Wasserstoffatom (mit rund 1 u die leichteste Atomsorte im PSE). Die relative Atommasse wurde eingeführt, um unhandliche Zahlen zu vermeiden, da zum Beispiel ein einzelnes Wasserstoffatom unwägbar leicht ist und – rein rechnerisch ermittelt – bloss 0.000'000'000'000'000'000'000'001'673 g wiegt.
Löse nun die Aufgaben 1–2.
Verbindungen bestehen aus verschiedenen Atomsorten
Beim Eisen-Schwefel-Versuch entstand als Produkt Eisensulfid (vgl. Abb. ganz rechts). Dieser Stoff zeigt einen regelmässigen Aufbau aus zwei Atomsorten (Schwefel, Eisen) und ist damit eine sogenannte Verbindung:
Eine Verbindung ist ein Reinstoff, der aus verschiedenen Atomen, d. h. aus 2 oder mehreren Atomsorten besteht.
Verbindungen können nur durch chemische Reaktionen in andere Stoffe zerlegt werden.
Als Verbindungen haben wir bereits die Sulfide (Verbindungen mit der Atomsorte Schwefel) und die Oxide (Verbindungen mit der Atomsorte Sauerstoff) kennengelernt. Verbindungen mit der Atomsorte Kohlenstoff heissen organische Verbindungen. Die restlichen Verbindungen heissen anorganische Verbindungen.
Atome, Moleküle, Verband
In den obigen Abbildungen sollte dir aufgefallen sein, dass je nach Stoff die Atome in unterschiedlicher Anzahl oder gar nicht miteinander verbunden sind. Wann Moleküle, Verbände oder einzelne Atome vorliegen, zeigen die folgenden drei Abbildungen:
Moleküle
Atome (nicht verbunden)
Verbände
Verbände (3-D-Ansicht)
Bevor du zum Versuch kommst, ist noch die Aufgabe 3 zu bearbeiten.
Synthese und Analyse
Verbindungen lassen sich unter Energieaufwand durch chemische Reaktionen zerlegen. Die Zerlegung einer Verbindung in Elemente heisst Analyse (vgl. Silberoxid-Versuch). Umgekehrt kann man aus Elementen eine Verbindung bilden, wobei Energie frei wird (vgl. Eisen-Schwefel-Versuch). Diesen Vorgang bezeichnet man als Synthese:
Synthese
Die Synthese von Eisensulfid auf Teilchenebene: Das Produkt Eisensulfid ist kein Gemisch, sondern eine Verbindung. Vor der Reaktion bilden die zwei Reinstoffe Schwefel und Eisen jedoch ein Gemisch (hellgraues Pulver mit dunkelgrauen und gelben Zonen). Aus der Abbildung ist ersichtlich, dass vor und nach der Reaktion gleich viele Schwefel- bzw. Eisenatome (je 8 Atome) vorliegen, also keine Atome verbraucht oder verändert wurden.
Analyse
Die Analyse von Silberoxid auf Teilchenebene: Der Ausgangsstoff Silberoxid ist kein Gemisch, sondern eine Verbindung. Nach der Reaktion bilden die zwei Reinstoffe Silber und Sauerstoff jedoch (kurzzeitig) ein Gemisch. Aus der Abbildung ist ersichtlich, dass vor und nach der Reaktion gleich viele Silberatome (24 graue Atome) bzw. Sauerstoffatome (12 rote Atome) vorliegen. Es wurden also auch hier keine Atome verbraucht oder verändert.
Löse nun die restlichen Aufgaben ab Aufgabe 4.
Die Aufgaben 1–3 werden vor dem Versuch bearbeitet.
Sämtliche acht Aufgaben müssen bearbeitet werden (Aufgaben 5–8 wohl als Hausaufgabe).
Nimm das Blatt "Periodensystem der Elemente" (PSE) zur Hand und vergleiche für die Elemente Sauerstoff und Eisen einige Angaben gemäss den folgenden Vorgaben:
- Studiere zuerst die Legende für das im PSE aufgeführte Musterbeispiel "Mg" (Magnesium):
- Halte für die Elemente Sauerstoff und Eisen jeweils die Ordnungszahl, das Elementsymbol, die Dichte und den Siedepunkt fest.
- Vergiss nicht für die gesuchten Grössen (z. B. Dichte) die Einheiten mit anzugeben.
- Weshalb ist das Elementsymbol für Sauerstoff in roter Schrift und jenes für Eisen in schwarzer Schrift?
- Was bedeutet der gelbe Hintergrund bei Sauerstoff und der blaue bei Eisen?
- Welche Aussage lässt sich aus der angegebenen relativen Atommasse beim Element Sauerstoff ableiten?
Die Atomsorte Sauerstoff (O) hat die Ordnungszahl 8 und eine Atommasse von 16 u. Der Elementarstoff Sauerstoff ist ein Nichtmetall (gelber Hintergrund) und bei 0 °C ein Gas (rote Schrift) mit einer Dichte von 1.43 g/Liter und einem Siedepunkt von –183 °C.
Das Metall (blauer Hintergrund) Eisen (Fe) ist das 26. Element im PSE mit einer Atommasse von rund 56 u. Bei 0 °C ist es ein Feststoff (schwarze Schrift) mit einer Dichte von 7.87 g/cm3 und einem Siedepunkt von 2861 °C.
Die relative Atommasse von 16 u bedeutet, dass ein O-Atom rund 16-mal schwerer als ein H-Atom (Wasserstoffatom) oder rund 3.5-mal leichter als ein Fe-Atom ist.
(Bearbeite nun die Aufgabe 2.)
Notiere dir mithilfe des PSE 4 bekannte Metalle, 4 bekannte Nichtmetalle und ein Halbmetall.
Bekannte Metalle (blauer Hintergrund) sind z. B.: Kupfer, Silber, Aluminium, Magnesium.
Bekannte Nichtmetalle (gelber Hintergrund) sind z. B.: Kohlenstoff, Schwefel, Chlor, Iod.
Möglicherweise hast du schon vom Halbmetall (blau-gelb schraffierter Hintergrund) Silicium oder Arsen gehört.
(Fahre nun im Theorieteil weiter mit dem Kapitel Verbindungen.)
Gemäss Lernzielen solltest du die Begriffe Elementarstoff, Verbindung, Molekül, Atom und Verband an gegebenen Beispielen erklären können. Wir fassen nun unser Wissen – basierend auf den bisher behandelten Beispielen – zusammen:
(Halte die folgenden zwei Abbildungen im Journal fest.)
(Nimm nun die CP-Anleitung zur Hand, studiere die Einleitung und starte anschliessend mit dem Versuch "Synthese von Eisenoxid".)
(Studiere zuerst die Theorie des letzten Kapitels Synthese und Analyse und kehre dann hierher zurück.)
Versuch: Synthese von Eisenoxid
Gib die Reaktion von Eisen mit Sauerstoff zu Eisenoxid auf Teilchenebene mit Kugeln wieder (analog zu den Abbildungen im Kapitel "Synthese und Analyse") und ordne den beteiligten Stoffen die Begriffe Verband, Molekül, Elementarstoff, Verbindung, Reinstoff oder Gemisch zu.
- Überlege dir zuerst, welche Stoffe molekular bzw. als Verband vorliegen.
- Sauerstoff (Nichtmetall → Moleküle); Eisen (Metall → Verband); Eisenoxid (Metall + Nichtmetall → Verband)
- Hinweis: Während Sauerstoff aus zweiatomigen Molekülen besteht (vgl. Theorie), bilden beim Produkt Eisenoxid die Eisen- und Sauerstoffatome – vereinfacht betrachtet – ein Gitter im Verhältnis 1:1.
- Nun solltest du die Reaktion im Kugelmodell zeichnen können. Beachte, dass links und rechts von jeder Atomsorte gleich viel Kugeln sind (also keine Atome verloren gehen).
- Gib für die 3 Stoffe ihren Namen an und ordne ihnen die Begriffe Elementarstoff oder Verbindung sowie Reinstoff oder Gemisch zu.
(Halte die folgende Abbildung in deinem Journal fest.)
Synthese von Eisenoxid auf Teilchenebene
(Bearbeite nun die restlichen Aufgaben 5–8.)
Die Reaktion von Eisen und Sauerstoff zu Eisenoxid lässt sich prinzipiell auch umkehren:
- Kennzeichne in deiner unter Aufgabe 4 erstellten Abbildung diesen Vorgang, d. h., halte die Richtung von Analyse und Synthese fest.
- Studiere nochmals deine Abbildung: Was passiert mit den Atomen ganz allgemein in einer chemischen Reaktion?
(Ergänze in deiner bereits erstellten Abbildung die Angaben zur Richtung der Synthese und Analyse.)
Synthese von Eisenoxid auf Teilchenebene
Bei einer chemischen Reaktion werden Atome weder verändert noch verbraucht, sie werden jedoch umgruppiert, d. h., sie wechseln den Bindungspartner.
Überlege dir, welche fehlenden Begriffe in der folgenden Abbildung zu ergänzen sind:
Eventuell musst du nochmals die Theorie zu Reinstoffen und Gemischen konsultieren.
(Halte die folgende Abbildung in deinem Journal fest.)
Übersicht über die Stoffkategorien
Versuch: Kupfermetallgewinnung aus Kupferoxid (CP 8)
Gib die folgende Reaktion aus dem Versuch "Kupfermetallgewinnung aus Kupferoxid" – unter Berücksichtigung der nachfolgenden Vorgaben und Hilfeleistung – auf Teilchenebene mit Kugeln wieder und ordne den beteiligten Stoffen die Begriffe Verband, Molekül, Elementarstoff, Verbindung, Reinstoff oder Gemisch zu:
Kupferoxid + Kohlenstoff → Kohlenstoffdioxid + Kupfer
- Überlege dir wiederum zuerst, welche Stoffe molekular bzw. als Verband vorliegen.
- Hinweis zu den Ausgangsstoffen: Bei Kupferoxid (Metall + Nichtmetall → Verband) bilden die Kupfer- und Sauerstoffatome ein Gitter im Verhältnis 1:1. Kohlenstoff wäre nach unseren Regeln (Nichtmetall → Moleküle) molekular aufgebaut, ist jedoch eine Ausnahme und bildet einen Verband.
- Hinweis zu den Produkten: Kohlenstoffdioxid (Nichtmetall + Nichtmetall → Molekül) besteht aus dreiatomigen Molekülen (ein C-Atom in der Mitte, links und rechts je ein O-Atom). Kupfer ist ein Metall (→ Verband).
- Tipp: Zeichne zuerst den Verband der Kohlenstoffatome, und zwar bloss mit 4 Kugeln (damit reduziert sich der zeichnerische Aufwand). Damit ist auch festgelegt, wie viele Kohlenstoffdioxid-Moleküle entstehen. Aus Letzterem folgt, wie viele O-Atome im Kupferoxidgitter sich befinden müssen. Und daraus lässt sich ableiten, wie viele Cu-Atome im Gitter vorhanden sein müssen.
- Nun solltest du die Reaktion im Kugelmodell zeichnen können. Kontrolliere nochmals, dass links und rechts von jeder Atomsorte gleich viel Kugeln vorhanden sind.
- Gib für die 4 Stoffe ihren Namen an und ordne ihnen die Begriffe Elementarstoff oder Verbindung sowie Reinstoff oder Gemisch zu.
(Halte die folgende Abbildung in deinem Journal fest.)
Kupfermetallgewinnung aus Kupferoxid auf Teilchenebene
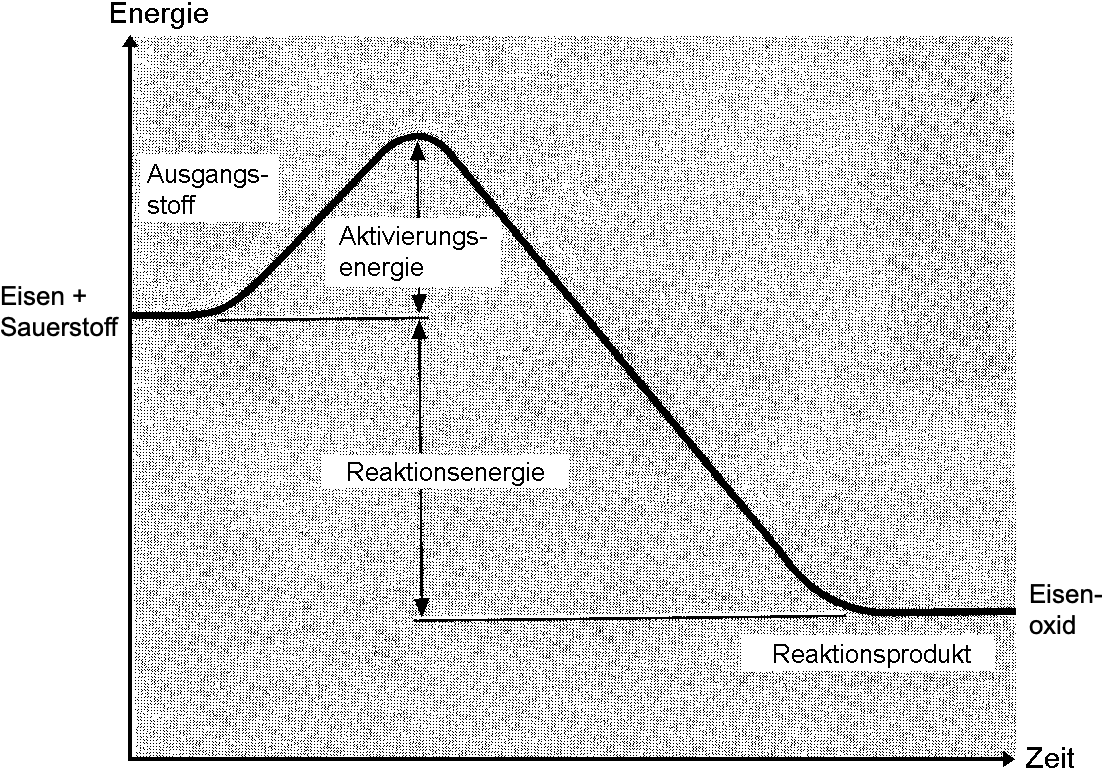
Erstelle ein Energiediagramm für den Versuch "Synthese von Eisenoxid".
- Liegt eine exotherme oder eine endotherme Reaktion vor? Begründe.
- Zeichne die zwei üblichen, relevanten Energiegrössen ein.
- Vergiss nicht die Namen der Ausgangsstoffe und Produkte zuzuordnen und die Achsen anzuschreiben.
- Falls du die Theorie zum Energiediagramm nicht mehr präsent hast, kannst du das entsprechende Kapitel im CP 8 nochmals studieren.
Es liegt eine exotherme Reaktion vor, da die Stahlwatte unter massiver Energiefreisetzung (Funkenbildung, gleissendes Licht) verbrannte, wobei sogar das Reagenzglas partiell aufschmolz. Zusätzlich liegt hier eine Synthese eines Stoffs aus Elementarstoffen vor, welche prinzipiell immer exotherm verlaufen.